Ишемический инсульт
По данным ВОЗ, инсульт — вторая по частоте причина смерти после ишемической болезни сердца. В России происходит почти полмиллиона инсультов в год. Каждый 8-й инсульт заканчивается смертью.
Ишемический инсульт случается при сдавливании или закупоривании мозговых артерий. Он встречается более чем в 80% случаев. По данным фонда по борьбе с инсультом ОРБИ, в большинстве случаев инсульт приводит к инвалидности и лишь 10-13% пациентов возвращается к прежней жизни. Последствия инсульта и жизнь человека зависят от того, насколько быстро оказали медицинскую помощь, от качества лечения и последующей реабилитации.
Ишемический инсульт: когда секунды на счету
Самыми частыми причинами ишемического инсульта головного мозга считаются атеросклероз и попадание тромба в артерии головного мозга.
Ишемия губительно влияет на головной мозг: нарушение циркуляции крови в клетках и их кислородное голодание приводят к гибели тканей. Степень повреждения тканей зависит от времени, которое они провели без кислорода, а также от индивидуальных особенностей больного.
Значительно увеличивают риск инсульта заболевания сердца, в том числе аритмия и гипертоническая болезнь, атеросклероз, сахарный диабет. Нарушение кровообращения также может произойти на фоне проблем со свертываемостью крови или длительного и интенсивного стресса. Курение, избыточный вес, отсутствие физических нагрузок — важнейшие факторы риска.
В рекомендациях ВОЗ предложена концепция под названием «Время — мозг». Ее суть проста: чем раньше пациенту с инсультом окажут медицинскую помощь, тем выше шанс сохранить максимально возможное количество клеток мозга, и, как следствие, восстановить большинство функций.
Важно вовремя распознать симптомы ишемического инсульта и обратиться за экстренной медицинской помощью. Как показали исследования, сами пациенты узнают симптомы инсульта только в 33–50% случаев. Поэтому ответственность ложится на родственников и людей, оказавшихся рядом.
Существует быстрый тест, который помогает выявить ишемический инсульт. Он называется F.A.S.T:
Face (лицо). Попросите человека улыбнуться. Если случился инсульт, один уголок рта будет опущен.
Аrms (руки). Попросите поднять обе руки и удерживать их 5 секунд. При инсульте одна рука опускается или человек совсем не может ей управлять.
Speech (речь). Попросите сказать простую фразу. При инсульте речь становится невнятной, неразборчивой.
Time (время). Как можно быстрее вызовите скорую помощь.
В ожидании врачей:
- Обеспечьте доступ воздуха. Исключите давление тугой одежды (расстегните пояс, ремень, галстук). Откройте окна.
- Переверните человека на бок на тот случай, если начнется тошнота.
- Не предлагайте человеку воды или еды. При ишемическом инсульте часто нарушается глотание, человек может захлебнуться.
- Запоминайте поминутно, что происходит с человеком, чтобы потом подробно рассказать об этом врачам. Когда они приедут, вы им здорово поможете.
- Будьте рядом, пока не приедут врачи. Говорите с пострадавшим и наблюдайте за связанностью речи.
После приезда скорой:
- Опишите точное время и порядок появления симптомов.
- Сообщите о хронических заболеваниях пациента (гипертоническая болезнь, сахарный диабет, перенесенный инфаркт миокарда).
- Расскажите о непереносимости лекарственных препаратов, а также о лекарствах, которые принимает пациент.
Желательно еще до приезда скорой подготовить все медицинские документы: выписки из истории болезни, страховой полис.
Во время транспортировки пациенту при необходимости окажут неотложную помощь:
- восстановление нормального дыхания;
- снижение артериального давления;
- купирование судорог;
- профилактику отека мозга;
- реанимационные мероприятия.
Оказание помощи в медицинском учреждении
Если пациента удалось доставить в больницу в течение трех часов после ишемического нарушения мозгового кровообращения, есть возможность выполнить процедуру тромболизиса (разрушения тромба). Быстрое устранение кислородного голодания в участках мозга позволит спасти значительную часть поврежденных тканей.
Для определения объема поражения мозга назначается рентген, компьютерная или магнитно-резонансная томография.
Терапию ишемического инсульта можно разделить на несколько основных направлений:
- Медикаментозное лечение. Направлено на улучшение кровообращения в пораженном участке, разжижение крови, снятие отека головного мозга, поддержание деятельности сердца, коррекцию уровня глюкозы;
- Насыщение крови кислородом. Оксигенотерапия проводится, если кровь насыщена кислородом менее, чем на 92–95%. Если это не помогает, пациента переводят на искусственную вентиляцию легких;
- Мероприятия по уходу за пациентом — правильное положение тела, адекватное питание и питьевой режим, профилактика пролежней, бинтование конечностей, уход за катетерами, аппаратами искусственного дыхания, массаж и гимнастика;
- Профилактика осложнений, в том числе пневмонии, инфекций мочевыводящих путей, образования тромбов.
Даже при своевременном оказании экстренных мер для лечения ишемического инсульта полностью восстанавливается только один из трех пациентов. Для повышения шансов на выздоровление (или частичное возвращение утраченных функций) показана реабилитация.
Последствия ишемического инсульта головного мозга
Негативные последствия ишемического инсульта зависит от объема поражения головного мозга, а также от расположения поврежденного участка.
После перенесенного ишемического инсульта развиваются:
- двигательные нарушения: парез (частичный паралич), слабость, тяжесть в конечностях (чаще с одной стороны тела), потеря мелкой моторики, потеря мимики на одной или обеих половинах лица;
- снижение чувствительности;
- нарушения речи: невнятная речь, затрудненность подбора слов, непонимание окружающих;
- нарушения зрения: черные пятна, общее ухудшение зрения, двоение в глазах;
- когнитивные нарушения: снижение внимания, памяти, снижение скорости и качества мышления, расстройства письма и чтения;
- нарушения эмоционального состояния, депрессия.
Прогноз восстановления после ишемического инсульта
Прогноз после перенесенного ишемического инсульта зависит и от социальных, психологических факторов, а также от качества реабилитации. Ишемический инсульт может привести к потере трудоспособности и к зависимости от окружающих: человек не может
позаботиться о себе, ему требуется специализированный уход. В 18 % случаев наступает повторный инсульт в последующие 5 лет жизни, если больной прекратил прием профилактических препаратов.
Очень важно, чтобы пациенту был подобран необходимый объем физических упражнений. Ограничение подвижности пациента после инсульта может привести к таким осложнениям, как застойные явления, тромбозы, пролежни, задержка стула, образование контрактур и развитие пневмонии.
Комплексная реабилитация позволяет значительно снизить риск смертности от последствий ишемического инсульта, снизить риск повторного инсульта, восстановить утраченные функции или компенсировать их, вернуть навыки самообслуживания, улучшить психологическое состояние.
Реабилитация после инсульта — важнейший этап терапии
Лечение последствий ишемического инсульта можно разделить на несколько направлений:
- Восстановление движения (занятия с физическим терапевтом, акватерапия, занятия на тренажерах, применение современных методик: Бобат-терапия, Экзарта, метод PNF);
- Возвращение независимости в быту (занятия с эрготепаревтом в специально оборудованной тренировочной квартире);
- Восстановление речи и глотания;
- Составление меню с рекомендациями лечащего врача;
- Контроль артериального давления и лекарственная терапия;
- Гигиенические процедуры (в том числе уход за стомами и снятие стом);
- Симптоматическое лечение (профилактика или лечение пролежней, снятие болевого синдрома и т.д.);
- Восстановление контроля органов таза;
- Лечение депрессивных состояний, помощь психолога.
Программа реабилитации проводится в три этапа.
Первый этап начинается с первых дней после перенесенного ишемического инсульта. Возможности активной реабилитации при этом ограничены, так как пациент находится в постели и малоподвижен. Пациента переворачивают, делают массаж, проводят дыхательную гимнастику.
Важно общаться с пациентом, даже если его собственная речь нарушена или он не может ответить. Восприятие речи влияет на работу функциональных участков мозга и положительно сказывается на эмоциональном и физиологическом состоянии человека.
Второй этап длится до нескольких месяцев после перенесенного инсульта. Он может проходить как непосредственно в стационаре, так и в специализированном реабилитационном центре. В этот период назначают массаж, лечебную гимнастику, физиотерапию. Специалисты работают над речью и когнитивными функциями (память, мышление, воображение). Этот этап может длиться до полугода: все зависит от тяжести перенесенного инсульта.
В позднем, третьем, реабилитационном периоде применяются активные методы для восстановления функций и навыков. Восстанавливается мелкая моторика, навыки самообслуживания. Важно также сформировать у пациента приверженность к мероприятиям по реабилитации и позитивный настрой.
В некоторых случаях достаточно одного или двух курсов реабилитации (пациента выписывают с подробными рекомендациями и комплексом упражнений, которые нужно выполнять дома).
Центр реабилитации «Три сестры» занимается лечением после ишемического мозгового инсульта. Каждый специалист проводит индивидуальный осмотр пациента и ставит определенные по времени и достижимые цели. Члены команды взаимодействуют между собой и обмениваются информацией, чтобы реабилитация была эффективной.
Источник
Стресс как причина ишемического инсульта
При любой патологии в организме создаются условия для интенсификации свободнорадикального окисления липидов и белков (СРО), в результате чего значительно возрастает количество молекулярных, первичных, вторичных и конечных продуктов, которые являются мощными прооксидантами, инициирующими процессы СРО. Развивается так называемый феномен «снежной» лавины, а именно: количества молекулярных первичных, вторичных и конечных продуктов значимо возрастает. Следующий этап этого процесса – проявление функционального дисбаланса в неферментативном и ферментативном звеньях эндогенной системы антиоксидантной защиты (АОЗ), которая не справляется с задачами регламентации и лимитирования уровней активных форм кислорода, свободных радикалов и молекулярных продуктов СРО, в результате чего создаются условия для формирования «свободнорадикальной патологии», или окислительного стресса. Стресс именно окислительный, а не оксидантный или оксидативный, как его называли раньше и порой называют и сейчас в публикуемых изданиях. Термин окислительный стресс более адаптирован для обозначения самого процесса, лежащего в основе его формирования, а именно свободно-радикального окисления. Оксиданты, прооксиданты и антиоксиданты являются «боевыми» единицами процесса свободнорадикального окисления и окислительного стресса. При этом отмечена прямая связь между уровнем активных форм кислорода, свободных радикалов, молекулярных продуктов СРО и интенсивностью проявления окислительного стресса, а именно их избыток как проявление окислительного стресса приводит к нарушению функционального и структурного состояния клеточных биомембран, что является одним из ключевых направлений в развитии патологии. Необходимо выделить два блока формирования окислительного стресса:
1. Интенсификация процессов СРО липидов и белков.
2. Функциональный дисбаланс в ферментативном и неферментативном звеньях эндогенной системы АОЗ.
Современные теории полигенной системы защиты организма рассматривают не только иммунную систему как основной фактор защиты, но и систему метаболизма, которая формирует метаболический барьер для защиты организма, или, выражаясь образно, метаболический иммунитет. Исходя из этих позиций взаимодействие процессов СРО и эндогенной системы АОЗ можно считать одним из механизмов развития метаболического иммунитета, тогда и окислительный стресс как проявление нарушения согласованного взаимодействия процессов СРО липидов и белков и эндогенной системы АОЗ можно рассматривать как поломку одного из механизмов в едином комплексе метаболического иммунитета, что окажет негативное влияние на жизнедеятельность организма и его взаимоотношение с меняющимися факторами внешней среды, что приведет к дезадаптации организма и развитию патологии. Таким образом, окислительный стресс следует рассматривать как одно из звеньев сложнейшего механизма патогенеза инсульта и рассеянного склероза [1, 2, 5]. Настоящее исследование посвящено верификации окислительного стресса, одного из звеньев сложнейшего патогенеза медико-социально и экономически значимых заболеваний нервной системы – инсульта и рассеянного склероза. Инсульт входит в рубрику цереброваскулярных заболеваний, являясь лидирующей причиной смертности, негативно влияющей на демографические показатели населения Российской Федерации. Рассеянный склероз – актуальнейшая проблема современной клинической неврологии. Болеют молодые талантливые юноши и девушки. Тяжелое течение этого заболевания приводит к высокой степени инвалидизации, выводя из активной творческой колеи жизни перспективную работоспособную часть населения. Научная ценность и практическая значимость работ, направленных на изучение сложнейших механизмов патогенеза инсульта и рассеянного склероза, состоит в том, что они позволяют разрабатывать перспективные патогенетически обусловленные подходы к лечению этих социально значимых заболеваний нервной системы [6].
Целью настоящего исследования является верификация двух блоков формирования окислительного стресса при инсульте и рассеянном склерозе.
Материалы и методы исследования
Группу исследования составили 120 пациентов, из них 60 больных с инсультом: ишемический инсульт (ИИ) – 30 и геморрагический (ГИ) – 30. Вторая группа пациентов – 60 больных рассеянным склерозом, которые были подразделены на 2 подгруппы: первично прогрессирующая форма клинического течения рассеянного склероза (ППРС) – 30, вторично прогрессирующая форма клинического течения рассеянного склероза (ВПРС) – 30. В контрольную группу вошли 30 исследуемых человек сопоставимого возраста с клиническими группами, но без проявлений заболеваний нервной системы – доноры.
В качестве субстратов для определения динамики параметров интенсивности свободнорадикального окисления липидов и белков, а именно параметров первичных, вторичных и конечных продуктов свободнорадикального окисления липидов и белков и активности эндогенной системы антиоксидантной защиты по маркерам неферментативного звена: витамин Е и восстановленный глутатион и ферментативного звена: глутатионпероксидаза и глутатионредуктаза, верифицирующей окислительный стресс при инсульте и рассеянном склерозе, у всех 120 пациентов использовалась цельная стабилизированная кровь, сыворотка, плазма крови и взвесь эритроцитов, полученные общепринятыми в биологической методологии способами. Таким же образом было проведено исследование субстратов и у 30 доноров. При этом применялись следующие методики исследования: спектрофотометрия, спектрокалориметрия, фотоэлектрокалориметрия и биохемилюминесценция. Для оценки достоверности различия показателей в сравниваемых группах по каждому показателю математически были рассчитаны выборочные средние, а также 95 % доверительные интервалы для генеральных средних.
Результаты исследования
и их обсуждение
Нами получены результаты параметров вторичных и конечных продуктов свободнорадикального окисления липидов и белков при ишемическом и геморрагическом инсульте, а также при рассеянном склерозе первично и вторично прогрессирующей клинической формы течения заболевания, которые представлены на рис. 1 и 2. Вторичный продукт свободнорадикального окисления липидов, а именно малоновый деальдегид, образуется в результате окислительной модификации углеводородных хвостов молекул липидов и жирных кислот, фактически в результате распада диеновых конъюгатов и кетодиенов. Повышение параметров малонового диальдегида свидетельствуют об избыточной активации процессов свободнорадикального окисления. Малоновый диальдегид очень токсичен и химически активен. Увеличение параметров малонового диальдегида сопровождается заметным снижением активности глюкозо-6-фосфатазы в эндоплазматическом ретикулуме, а также различных АТФаз и ацетилхолинэстеразы в эритроцитах. Таким образом малоновый диальдегид оказывает повреждающее действие, связанное с нарушением структурно-функционального состояния биомембран. Способствует увеличению их проницаемости для Ca2+, что может влиять на возникновение его избытка в клетке с реализацией повреж-
дающего действия.
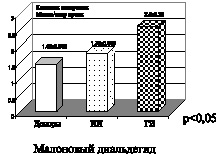
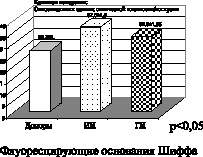
Рис. 1. Ишемический (ИИ) и геморрагический инсульт (ГИ)
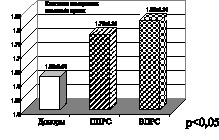
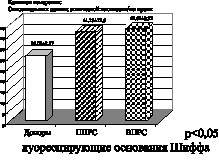
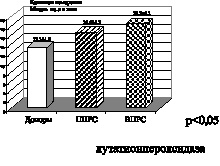
Рис. 2. Рассеянный склероз. Первично прогрессирующая (ППРС) и вторично прогрессирующая (ВПРС) клинические формы течения рассеянного склероза
На представленных рисунках при ишемическом, в большей степени геморрагическом инсульте, а также при склерозе первично и вторично прогрессирующих клинических формах рассеянного склероза четко отмечено увеличение параметров малонового диальдегида, что подтверждает интенсификацию процессов свободнорадикального окисления липидов при вышеперечисленных клинических формах заболеваний. Вторичный продукт СРО – малоновый диальдегид, взаимодействуя с N-концевыми остатками аминокислот и аминогруппами фосфолипидами, образуют конъюгированные флуоресцирующие соединения типа основания Шиффа. Эти соединения являются более стабильными, конечными продуктами СРО липидов и белков. Их утилизация в организме происходит с очень низкой скоростью, в результате чего они накапливаются в тканях организма как балласт. Увеличение параметров оснований Шиффа при геморрагическом и больше при ишемическом инсульте, а также при первично прогрессирующей и вторично прогрессирующей клинических формах течения рассеянного склероза свидетельствует о тенденции к хронизации и избыточной активации процессов свободнорадикального окисления липидов и белков.
Полученные данные исследования позволяют сделать вывод о том, что при ишемическом и геморрагическом инсульте, а также при первично прогрессирующей и вторично прогрессирующей формах рассеянного склероза имеет место формирование первого блока окислительного стресса, а именно интенсификация процессов свободнорадикального окисления липидов и белков.
Активация процессов СРО липидов и белков при анализируемых нами формах логически требует увеличения активности маркеров неферментативного и ферментативного звеньев эндогенной системы антиоксидантной защиты [3, 4]. Проанализируем полученные нами в процессе исследования данные показателей активности маркеров АОЗ, а именно маркеров неферментативного звена эндогенной системы антиоксидантной защиты: витамина Е, восстановленного глутатиона при ишемическом и геморрагическом инсульте и витамина Е и общих тиолов при первично прогрессирующей и вторично прогрессирующей формах рассеянного склероза, которые представлены на рис. 3, 4.

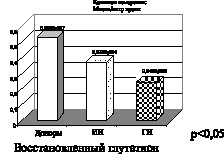
Рис. 3. Ишемический (ИИ) и геморрагический инсульт (ГИ)
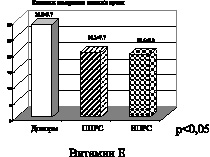
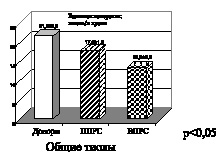
Рис. 4. Рассеянный склероз. Первично прогрессирующая (ППРС) и вторично прогрессирующая (ВПРС) клинические формы течения рассеянного склероза
На рис. 3 представлены показатели активности витамина Е и восстановленного глутатиона. Витамин Е является одним из основных эндогенных антиоксидантов, а именно эффективно «тушит» синглетный кислород и «перехватывает» свободные радикалы непосредственно реагируя с ними на стадии обрыва цепей. Антиоксидантную активность витамина Е связывают также с его взаимодействием с перекисными соединениями органической природы. Представленные на рисунке данные указывают на снижение активности витамина Е при геморрагическом и в большей степени ишемическом инсульте.
Восстановленный глутатион – эндогенный антиоксидант, который участвует в реакциях с гидроперекисями, сам при этом окисляется. Используется в работе антиперекисного комплекса в качестве субстрата, а именно глутатионпероксидаза взаимодействует с восстановленным глутатионом в реакциях с гидроперекисями, и при этом глутатион окисляется. Окисленный же глутатион является субстратом для работы глутатионредуктазы, которая в результате взаимодействия с гидроперекисями переводит его в восстановленное состояние – восстановленный глутатион, который вновь используется субстратом для реакций, в которых участвует глутатионпероксидаза. Глутатион участвует в транспорте аминокислот, а также в поддержании субгидрильных групп белков в восстановленном состоянии. Снижение его показателей активности, представленное на рис. 3, свидетельствует о дисбалансе в ферментативном и неферментативном звеньях
эндогенной системы антиоксидантной защиты при ишемическом и геморрагическом инсульте.
На рис. 4 при первично и вторично прогрессирующих клинических формах течения рассеянного склероза также отмечено снижение активности витамина Е. Снижение показателей активности витамина Е свидетельствует о функциональном дисбалансе в неферментативном звене эндогенной системы антиоксидантной защиты. Антиоксидантными свойствами обладают и соединения, содержащие сульфгидридные группы, относящиеся к неферментативному звену системы АОЗ. Это общие тиолы –SH-группировки, которые взаимодействуют с активными формами кислорода и перекисными радикалами, восстанавливая последние до нетоксичных продуктов. Снижение показателей активности общих тиолов, представленное на рис. 4, еще раз подтверждает наличие функционального дисбаланса в эндогенной системе антиоксидантной защиты. На рис. 5, 6 представлены графики показателей активности глутатионпероксидазы и глутатионредуктазы маркеров ферментативного звена эндогенной системы антиоксидантной защиты.

Рис. 5. Ишемический (ИИ) и геморрагический инсульт (ГИ)
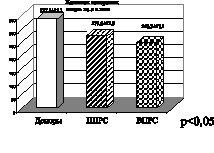
Активность глутатионредуктаза Активность глутатионпероксидаза
Рис. 6. Рассеянный склероз. Первично прогрессирующая (ППРС) и вторично прогрессирующая (ВПРС) клинические формы течения рассеянного склероза
Глутатионпероксидаза – фермент, катализирующий превращение перекиси водорода и органических гидроперекисей до гидросоединений, которые в дальнейшем могут метаболизироваться клеточными системами. Эффективность глутатионпероксидазного механизма восстановления гидроперекисей в значительной степени зависит от уровня основного донора для осуществления этой реакции – восстановленного глутатиона. Поддержание достаточного уровня восстановленной формы глутатиона, окисляющегося при функционировании глутатионзависимых антиперекисных систем, осуществляется ферментом глутатионредуктазой. Глутатионредуктазу относят к ферментативному звену АОЗ. Субстратом для работы глутатионредуктазы является окисленный глутатион, который она переводит в восстановленный. Активность фермента возрастает при увеличении концентрации восстановленных форм
перидиннуклеотидов и окисленного глутатиона. Таким образом, глутатионредуктаза и глутатионпероксидаза формируют замкнутый антиперекисной комплекс. На рис. 5, 6 представлены показатели активности глутатионпероксидазы и глутатионредуктазы, при этом необходимо отметить, что при ишемическом инсульте отмечено снижение показателя активности глутатионпероксидазы, при геморрагическом инсульте в меньшей степени, а при рассеянном склерозе первично и вторично прогрессирующих клинических форм течения имеет место снижение активности глутатионредуктазы. Это подтверждает наличие функционального дисбаланса в ферментативном звене эндогенной системы антиоксидантной защиты. Таким образом, на основании полученных нами данных подтверждается формирование второго блока окислительного стресса, а именно функциональный дисбаланс в неферментативном и ферментативном звеньях эндогенной системы антиоксидантной защиты при геморрагическом, ишемическом инсульте, а также при первично и вторично прогрессирующих клинических формах течения рассеянного склероза.
Анализируя все полученные данные по параметрам интенсивности свободнорадикального окисления липидов и белков, а также показателям активности ферментативного и неферментативного звеньев эндогенной системы антиоксидантной защиты, можно сделать вывод о верификации окислительного стресса в патогенезе ишемического, геморрагического инсульта и первично, вторично прогрессирующих форм клинического течения рассеянного склероза, что является основанием для назначения антиоксидантов в комплексном лечении инсульта и рассеянного склероза. Успешное лечение этих тяжелых заболеваний улучшит качество жизни пациентов.
Рецензенты:
Алабовский В.В., д.м.н., профессор, заведующий кафедрой биохимии, ВГМА им. Н.Н. Бурденко, г. Воронеж;
Лаврентьев А.А., д.м.н., профессор кафедры реанимации и анестезиологии ИДПО, ВГМА им. Н.Н. Бурденко, г. Воронеж.
Источник