Как растения запоминают стрессы
Антистрессовые белки у растений помогают переупаковать ДНК так, чтобы при будущих неприятностях антистрессовые программы срабатывали эффективнее.
Как и все живые существа, растения время от времени переживают разные стрессовые обстоятельства, например, слишком высокую или слишком низкую температуру, нехватку воды и т. д. И, как у всех живых существ, у растений есть механизмы, которые помогают справиться со стрессами.
Один такой механизм связан с гормоном абсцизовой кислотой. Она особенно важна для поддержания водного баланса при засухе; при недостатке влаги уровень абсцизовой кислоты резко увеличивается, и она довольно быстро заставляет закрыться устьица растений – особые поры на листьях, через которые происходит газообмен и испаряется вода. Кроме того, абсцизовая кислота заставляет корни активнее всасывать воду.
Другая антистрессовая система включает в себя так называемые шапероны, или белки теплового шока. При повышении температуры у многих белковых молекул нарушается пространственная структура и они начинают плохо работать. Белки теплового шока (которые вообще чрезвычайно распространены в живой природе) как раз помогают другим белкам не терять рабочую форму при слишком высокой температуре.
Однако в антистрессовых механизмах важна не только реакция на текущий стресс, но и возможность запомнить, что с тобой происходило, чтобы в будущем в похожей ситуации быстрее среагировать.
Сотрудники Федерального научного центра биоразнообразия наземной биоты Восточной Азии Дальневосточного отделения РАН, Национального университета Тайваня и Тайнаньского национального университета в статье в Trends in Plant Science описывают молекулярные связи, которые координируют два антристрессовых механизма и помогают запомнить антистрессовую инструкцию на будущее. Ранее исследователи получили карту белок-белковых взаимодействия в растениях арабидопсиса. Анализируя, какие белки взаимодействуют друг с другом, можно понять, как координируются те или иные процессы в живом организме. Оказалось, что белки, обслуживающие систему абсцизовой кислоты, связаны с белками теплового шока через белки SWI/SNF. Эти SWI/SNF управляют упаковкой ДНК, а от упаковки ДНК, как известно, зависит активность генов: те гены, которые находятся в плотноупакованных участках ДНК, будут менее активны, те, которые находятся в слабоупакованных участках – более.
Когда анстистрессовые системы активируются, они взаимодействуют с SWI/SNF так, чтобы в упаковке ДНК сохранилась печать стресса, и в следующий раз реакция на стресс будет более эффективной. При этом как именно формируется такая память о стрессе, зависит от конкретных условий. Например, у китайских и индийских подвидов риса механизм отличается по степени проявления, так как для обоих подвидов привычны разные температуры.
С практической точки зрения новые результаты важны для сельского хозяйства. Попав в экстремальные условия и пока ещё к ним не приспособившись, растения хуже растут, у них уменьшается урожайность, так что порой до половины урожая может быть потеряно из-за неэффективной работы антистрессовых механизмов. С помощью биоинженерных методов сельскохозяйственным культурам можно улучшить память на стресс, чтобы их продуктивность всегда оставалась на высоте.
Работа поддержана Российским научным фондом (РНФ).
Источник
Стрессовые белки — ключ к разгадке жизни
Стрессовые
белки — ключ к разгадке жизни
Галина КИСЕЛЕВА,
журналист
Любопытно,
что разговор об этом с заместителем
директора Сибирского института
физиологии и биохимии растений,
доктором биологических наук,
профессором Виктором ВОЙНИКОВЫМ мы
вели в день, когда за окном стоял
редкий даже для Сибири мороз.
Температура в кабинете достигала
едва ли 6 градусов. Мы кутались в
шубы и говорили о том, как растения,
а значит, и все живые организмы,
«согреваются» в холод и как
научиться управлять этими
процессами. Тогда я впервые и
услышала о «стрессовых
белках».
— Виктор
Кириллович, так что же такое
«стрессовые белки»?
— Это белки,
которые образуются в клетках всех
организмов, начиная от бактерий,
растений, животных до человека, в
ответ на какие-то неблагоприятные
воздействия окружающей среды,
скажем, на резкое повышение или
понижение температур, воздействие
токсических веществ, состояний,
вызывающих гипоксию. Все
отклонения от нормальных условий
обитания организма приводят к тому,
что клетка реагирует на эти
изменения и «включает»
соответствующие природные
механизмы, экспрессию определенных
генов. Как результат такой
экспрессии и появляются белки,
которые условно называются
стрессовыми белками.
Само понятие
» стрессовые белки» возникло
не очень давно, лет 10-15 назад. Надо
сказать, что именно в нашей
лаборатории физиологической
генетики СИФИБР были начаты
исследования, которые можно
назвать пионерными, и получены
результаты, которые можно отнести к
числу приоритетных.
— Вы
первыми придумали им такое
название?
— Первые
публикации появились в 70-х годах.
Они показали возможность
экспрессии генов дрозофилы в ответ
на повышение температуры. Через
некоторое время другие
исследование показали, что
экспрессия генов приводит к
накоплению белков, которые были
названы белками теплового шока.
Очень долго они так и назывались, да
и сейчас белки этого класса,
которые образуются при повышении
температуры, называются БТШ. И все
белки, образование которых вызвано
воздействием изменения среды,
часто тоже так именуют, но сейчас
чаще применяется второй термин —
«стрессовые белки», поскольку
он точнее. Название БТШ родилось не
у нас. А стрессовыми белки, скорее
всего, были названы с нашей подачи.
В своих публикациях мы чаще других
их так именовали. И это как- то
закрепилось.
— Что
нового вы внесли в знания об этих
удивительных белках?
— Со
стрессовыми белками мы начали
работать достаточно давно (я, в
частности, когда еще был аспирантом
и учился в Новосибирске). Изучая
холодоустойчивость растений, мы
обнаружили, что ряд
физиологических и биохимических
параметров растений сильно
меняется (в зависимости от
генотипа) в ответ на то или иное
стрессовое воздействие. В
результате нам удалось найти
хромосомы, в которых локализованы
гены, отвечающие за синтез
«холодовых» стрессовых белков.
В то время (77-78 годы) о белках
холодового шока даже не говорили.
Знали только о белках теплового
шока. Наши работы вызвали бурную
реакцию.
Мы впервые
показали, что в ответ не только на
повышение, но и на понижение
температуры происходит синтез
новых стрессовых белков. В то время
это был достаточно неожиданный
результат. Считалось, что если при
повышении температуры, когда
ускоряются все реакции, появляются
новые белки, — это процесс
естественный и понятный. Но когда
температура понижается, какое же
может быть усиление деятельности в
клетке? Напротив, все должно
успокаиваться, затухать, и о новом
синтезе, об образовании новых
белков и речи быть не может! Это и
для нас было странно: как при
снижении температуры клетка могла
запустить новые синтезы? Но
многочисленные эксперименты
убеждали нас в правильности
выводов. Стоило больших трудов
доказать свою правоту другим,
пробить дорогу публикациям.
Среди новых
синтезов как раз и оказались эти
белки холодового шока, которые мы
назвали стрессовыми белками. Чем
дальше мы продвигались вперед, тем
становилось интереснее.
Оказывается, растения могут делать
те вещи, которые присущи всем живым
организмам. Парадоксально, но они
могут сами себя «греть», когда
им «холодно»! Это трудно
воспринималось вначале. Понятно,
что теплокровное животное или
человек могут поддерживать
температуру своего тела вне
зависимости от температуры
окружающей среды. Известно, что и
некоторые насекомые могут повышать
температуру, известно даже, что
растения в определенные моменты
онтогенеза могут повышать
температуру. Но чтобы растение
пыталось «согреваться» в тот
момент, когда его охлаждают, было
совершенно неожиданно, непонятно.
Но оказалось, это так.
Происходит
вот что. Как и во всех живых
организмах, в растениях есть особые
органеллы — митохондрии, своего
рода энергетические станции. Они
выделяют энергию либо в химических
реакциях, либо, при определенных
условиях, могут переходить на
режимы выброса тепла.
Выяснилось,
что в клетке есть вещества, которые,
реагируя на холод, передают сигнал
в митохондрии и заставляют их
переходить на новый режим работы. К
таким веществам относятся,
например, свободные жирные кислоты.
И, как мы и предполагали, когда
начинали работу, с этим процессом
связаны именно стрессовые белки.
Наша
лаборатория изучила множество,
целое семейство холодовых белков, и
один из них оказался особенно
интересным — он носит название
«белок холодового шока 310».
Когда такие белки попадают в
митохондрии, они вызывают тот самый
термогенез, который позволяет
растению локально повысить
температуру в определенных частях
клетки и подготовиться к
охлаждению.
Когда
снижается температура окружающего
воздуха, температура клетки должна
снизиться, все процессы должны
замедлиться, что может привести к
образованию кристаллов льда в
клетке, разрыву ее структур и
гибели. Но если перед тем, как это
наступит, клетке дать возможность
«подготовиться», то она может
пережить даже сильное охлаждение.
Этот период подготовки требует
более комфортных условий. И клетка
сама себе их создает, подогревает
себя, запуская определенные
механизмы. В течение
«подготовительного» часа
происходит обезвоживание клетки,
перестройка ее ферментов и многие
другие процессы, что позволяет ей
встретить холодную температуру без
потерь.
— И обо
всем этом стало известно благодаря
исследованиям только вашей
лаборатории?
— В науке так
не бывает. Вопросами адаптации
занимались многие. Мы сделали свои
обнаружения не на пустом месте.
Установление роли стрессовых
белков в этих процессах — это наша
заслуга, изучение термогенеза в
растениях — тоже.
— Как
можно использовать эти знания?
— Эти знания
нужны, чтобы, во-первых, понимать те
процессы, которые происходят в
клетке, понимать механизмы, которые
ведут к адаптации, а это, в свою
очередь, важно для понимания того,
как функционируют те или иные
молекулы, структуры, соединения.
Что дало открытие стрессовых
белков? Прежде всего, оно привело к
важному в нашей науке открытию
белков шаперонов. Это белки,
которые предохраняют молекулы
других белков, и не только белков,
от повреждений при действии
стресса. Шапероны — один из классов
стрессовых белков. Их много, и они
имеют разные функции при стрессе.
Функции шаперонов очень важны — они
обеспечивают функционирование
различных макромолекул. Не трудно
представить, как много областей
применения может иметь такое
открытие.
Что касается
«холодовых» стрессовых белков,
среди них тоже есть шапероны. Кроме
того, есть стрессовые белки,
которые, как антифриз, который
заливается в двигатели
автомобилей, не дают клетке
образовывать кристаллы льда. Есть и
другие классы стрессовых белков с
очень интересными функциями.
Исследования
наши привели к тому, что мы начали
понимать неизвестные раньше
секреты жизни растений, механизмы
их защиты от неблагоприятных
условий. Где это можно применить?
Можно, например, целенаправленно
проводить селекцию. Вырабатывать у
растений, живых организмов
устойчивость к холоду, к недостатку
влаги, кислорода и т.д.
— Как
оцениваются ваши работы научной
общественностью?
— Нас
публикуют в отечественных и
международных журналах, приглашают
выступить на конференциях. Вот
лежит приглашение на престижнейшую
Гордоновскую конференцию, которую
называют «послезавтрашним днем
науки». По правилам, принятым на
ней, доклады, там прозвучавшие,
нигде не публикуют, нельзя делать
их записи или снимки.
Сотрудник
нашей лаборатории кандидат наук
Александр Рудиковский в свое время
получил первую премию Общества
физиологов России. Кандидаты наук
Геннадий Боровский и Алексей
Колесниченко получили по гранту СО
РАН. У меня была так называемая
президентская стипендия.
— Виктор
Кириллович, что вы мечтаете еще
успеть сделать?
— Ученый
подобен ребенку, разбирающему по
частям игрушечную машину, чтобы
понять, что же там, внутри. Хочется
понять, как эта штука, под названием
жизнь, устроена. В своих
исследованиях мы затронули только
верхушечку айсберга. Стрессовые
белки — это интереснейший объект
для исследований, который может
стать ключом для понимания многих
секретов жизни. В ближайшее время
произойдет выделение генов,
ответственных за процесс
«подготовки к стрессам», а
дальше… Трудно даже загадывать, к
каким необычным открытиям это
может привести.
Источник
Действие низкой температуры на растения. Белки стресса растений
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
ДЕЙСТВИЕ НИЗКОЙ ТЕМПЕРАТУРЫ НА РАСТЕНИЯ
За более чем столетний период изучения действия на клетки растений низких положительных и отрицательных температур знания о вызываемых ими изменениях в метаболизме растительных клеток, а также о свойствах клеток растений, определяющих их морозостойкость, значительно углубились и расширились.
В настоящее время считается, что основными причинами, вызывающими гибель растений от холода, являются или непосредственное действие низких температур на клетки, не связанное с образованием льда в тканях, или же образование льда в тканях снаружи клеток (в межклетниках) либо внутри них (Самыгин, 1969). С одной стороны, было установлено, что внутриклеточное замерзание воды всегда приводит к их немедленно гибели, во всяком случае, в лабораторных условиях, имитирующих природные. С другой стороны, все растения, зимующие в условиях умеренного климата, переносят внеклеточное замерзание значительных количеств воды.
Мгновенное и необратимое повреждение клеток при образовании внутриклеточного льда указывает на физическую природу процесса: вероятнее всего происходит разрушение мембран клетки растущими в протоплазме кристаллами льда (Левитт, 1983). В тоже время, рассматривая причины вымерзания растений, Г.А. Самыгин (1974) отмечает, что в природных условиях очень редко имеет место внутриклеточное образование льда, поскольку оно возможно только при очень быстром снижении температуры, достигающим 10-12 0 С в час. В естественных же условиях температура воздуха снижается со скоростью 1-2 0 С в час или даже еще медленнее. В этом случае происходит внеклеточное образование льда.
Повреждения при образовании льда вне клеток вызываются двумя основными причинами: обезвоживанием протопластов и механическими повреждениями обезвоженной протоплазмы. У закаленных растений преимущественно причиной гибели являются механические повреждения, у незакаленных – обезвоживание протоплазмы (Дроздов и др., 1977).
Обезвоживание растительно клетки имеет ряд опасных для нее последствий, которые могут привести ее к гибели. Это, во-первых, повышение концентрации растворенных веществ, и, прежде всего, солей; во-вторых, изменение рН внутриклеточных растворов; в третьих, образование ковалентных связей между макромолекулами; в четвертых, конформационные изменения структуры макромолекул из-за снижения содержания стабилизирующих их молекул воды; в-пятых, нарушение структуры мембран, и наконец, в шестых, это повреждение структуры протоплазмы при обратном поглощении воды (Левитт, 1983).
Особенно чувствительными структурами клетки, легко повреждающимися под действием гипотермии, являются клеточные мембраны. Функциональная устойчивость липидосодержащих протоплазматических структур, таких как плазмалемма и мембраны хлоропластов и митохондрий, легко нарушается под действием экстремальных температур (Белерадек, 1964). В частности, рядом авторов (Heber, 1967; Santarius, Heber, 1967) было показано, что замораживание вызывает необратимое подавление окислительного фосфорилирования в митохондриях. По их мнению, основной причиной повреждения клетки морозом является нарушение структуры мембран и потеря ими осмотических свойств. По мнению других авторов (Пушкарь, Белоус, 1975), важнейший фактор повреждения мембран при замораживании – их обезвоживание. Удаление воды из мембран при замораживании нарушает равновесие между системами белок – липид и белок – вода, в результате чего возникают структурные перестройки молекулярных слоев и изменяются свойства мембран. Обособление белков от липидов в мембране приводит к полному ее разрушению и в дальнейшем мембранные липиды могут стать субстратом для окисления. Наличие лишь незначительного числа нарушений мембранной структуры вызывает утечку протонов и разобщение окисления и фосфорилирования. Возможно повреждение мембран и без образования льда, когда низкая температура вызывает затвердение липидной части мембраны и нарушение ее структуры и функций.
Впоследствии многочисленные исследования показали сильную зависимость состава мембран растительной клетки от температуры роста растения. В частности, показано, что низкие температуры индуцируют в растениях разных видов накопление фосфолипидов и повышение ненасыщенности липидов (Нюпиева и др., 1980; Новицкая, Зверкова, 1982; Буколова и др., 1992; Siminovitch et al., 1968; Smolenska, Kuiper, 1977; Horvath et al., 1980). При этом были отмечены различия в содержании фосфолипидов у высоко- и низкохолодостойких сортов растений. В частности, такие различия были отмечены у высоко- и низкохолодостойких сортов люцерны (Kuiper, 1970; 1974), а также различающихся по холодоустойчивости сортов озимой пшеницы (Horvath et al., 1980), при этом наибольшие отличия в фосфолипидном составе листьев высоко- и низкохолодостойких сортов озимой пшеницы были отмечены после прохождения растением процесса низкотемпературной адаптации. Наиболее важным фактором в этом случае было возрастание доли фосфатидилхолина в составе мембран (Horvath et al., 1980). Сходные результаты были получены и при изучении проростков озимой пшеницы. У проростков, выращенных при 2 0 С, было обнаружено значительно более высокое содержание фосфолипидов, чем у проростков, выращенных при оптимальных температурах (de la Roche et al., 1975). У растений озимой пшеницы наблюдались также генотипические особенности содержания фосфолипидов в узлах кущения. Содержание как суммарных фосфолипидов, так и их отдельных фракций, таких как фосфатидилхолина и фосфатидилэтаноламина, было выше у морозостойкого сорта (Оканенко, Проценко, 1977). Аналогичные результаты были получены и при изучении липидного состава корне озимой ржи во время роста при пониженных температурах (Clarkson et al., 1980).
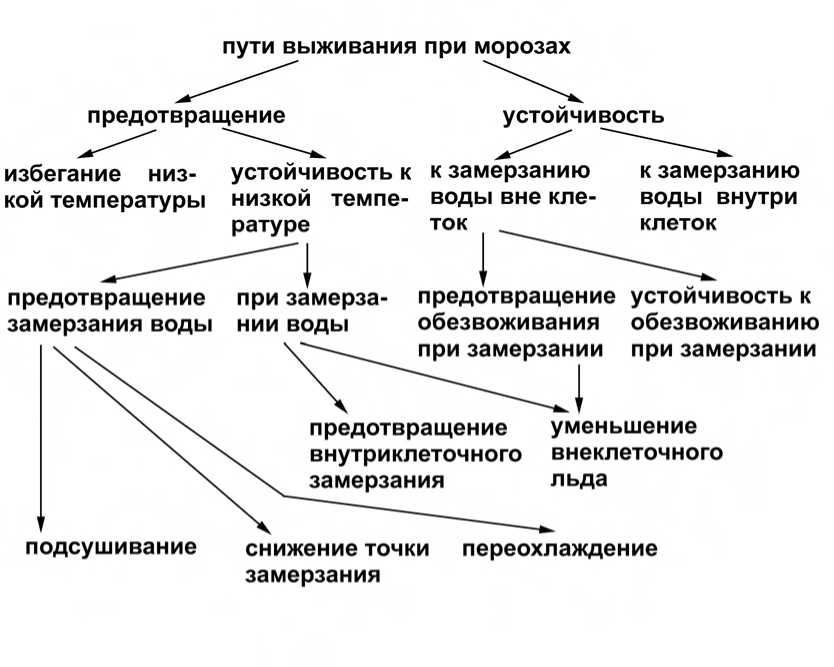
Для того, чтобы растения выживали после действия гипотермии, необходимо или предотвращение повреждений от действия внеклеточного или внутриклеточного замерзания, или ликвидация таких повреждений. Это свойство растений, определяемое как морозоустойчивость, должно включать в себя как предотвращение воздействия повреждающих факторов, так и устойчивость к их действию (рис. 1) (Левитт, 1983).
Рис. 1 Возможные пути выживания и устойчивости растений при морозах (цит. по Левитт, 1983).
Предотвращение воздействия повреждающих факторов возможно следующими путями:
- предотвращение воздействия низко температуры (из-за по килотермной природы растений считается, что этот способ защиты растений от гипотермии встречается редко, лишь в тех случаях, когда низкая температура действует в течение короткого периода);
- предотвращение замерзания путем высушивания (этот способ возможен лишь для покоящихся структур высших растений);
- предотвращение замерзания нормально гидратированных клеток может осуществляться путем накопления растворимых веществ;
- предотвращение замерзания вследствие переохлаждения обеспечивает выживание определенных тканей у многих древесных культур;
- предотвращение образования льда внутри клеток у растений обеспечивается различными способами и сохраняет жизнеспособность растений лишь в том случае, если они устойчивы к внеклеточному замерзанию;
- уменьшение количества льда при замерзании воды вне клеток идентично предотвращению обезвоживания при замерзании (Левитт, 1983).
В большинстве случаев для выживания растений недостаточно предотвращения повреждений, а необходима еще и устойчивость к замораживанию некоторых тканей и, вследствие этого, их обезвоживанию (Левитт, 1983). Растение может переносить обезвоживание тканей морозом двумя путями: во-первых, путем предотвращения летального обезвоживания при замерзании посредством действия накопленных растворимых веществ и, во-вторых, повышением устойчивости растений к обезвоживанию при замерзании, обусловливающей высокую морозостойкость тех видов, у которых не наблюдается корреляция между степенью морозоустойчивости и накоплением растворимых соединений.
В отличие от древесных растений, травянистые не входят в конце лета в состояние глубокого покоя. Их ткани, несмотря на вынужденную приостановку роста, сохраняют способность к нему на протяжении все зимы. В то же время, несмотря на то, что неблагоприятные температурные условия вызывают в их клетках ряд последовательных изменений: снижение водного потенциала, нарушение метаболизма и др. У видов, способных к закаливанию, надземные ткани переносят температуру до – 20…-25 0 С после предварительного воздействия закаливающих условий (Касперска-Палач, 1983).
Закаливание озимых растений происходит в три фазы, которые связаны с различными температурными условиями:
- первая фаза закаливания индуцируется снижением температуры до 2 – 5 0 С, в результате чего исходная морозостойкость повышается на 4-5 0 С;
- вторая фаза связана с небольшими морозами (от 0 0 С до -2 – -3 0 С) и в естественных условиях проходит только в том случае, если температура воздуха снижается ниже 0 0 С (если температурные условия, предшествующие закаливанию, были благоприятны для роста, то на это стадии может достигаться максимальная устойчивость тургесцентных тканей);
- третья фаза закаливания может совпадать со второй и зависит от продолжительных морозов, вызывающих обезвоживание клеток.
При изучении процессов закаливания различными исследователями было установлено, что во время перво фазы закаливания в растениях происходят изменения метаболических процессов, таких как гидролиз крахмала и накопление редуцирующих сахаров (Касперска-Палач, 1983) и водорастворимых белков (Родченко, 1985; Kasperska-Palacz, Wcislinska, 1972а,б). Другими метаболическими изменениями, которые тоже являются специфическим ответом растительных тканей на понижение температуры среды, являются превращения липидов и фосфолипидов. Установлено, что низкие положительные температуры повышают ненасыщенность жирных кислот (Grenier et al., 1972; Smolenska, Kuiper, 1977). Было также показано, что содержание фосфолипидов (в частности, фосфатидилхолина и фосфатидилэтаноламина) в тканях растений пшеницы возрастало при низкотемпературном закаливании (de la Roche et al., 1972; Grenier, Willemot, 1974).
Существует ряд доказательств того, что накопление в тканях растений в результате воздействия низких положительных температур некоторых веществ происходит не только вследствие уменьшения их утилизации в ходе ростовых процессов ввиду их приостановки, но и в результате усиления их новообразования (Ериф, 1966; Титов и др., 1992). Увеличение ненасыщенности жирных кислот фосфолипидов в условиях пониженных температур, как было показано, тоже в значительно степени связано с их синтезом (Willemot, 1975). Все эти данные свидетельствуют о том, что на перво фазе закаливания у травянистых растений происходит предпочтительны синтез некоторых метаболитов.
Что касается отрицательных температур, которые необходимы для прохождения второй фазы закаливания, то предполагается, что их роль в процессе закаливания не сводится только к физическому (обезвоживающему) действию. По-видимому, она также связана с некоторыми метаболическими процессами, протекающими при этих температурах (Касперска-Палач, 1983).
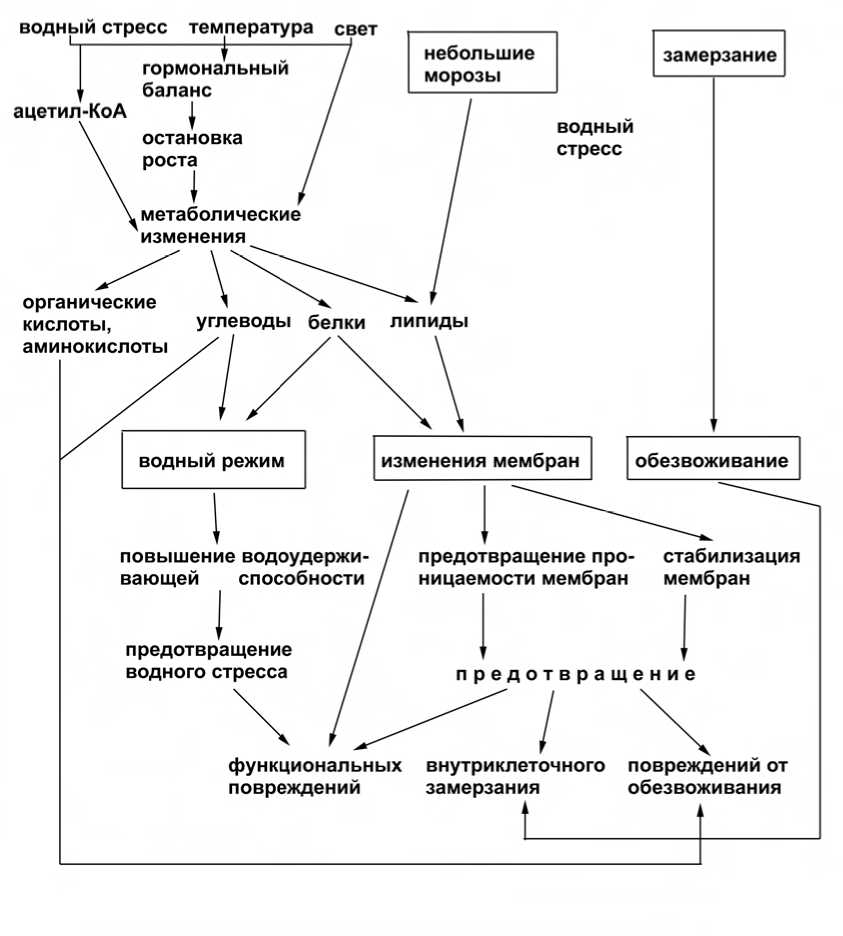
Поскольку прекращение роста растений является необходимым условием прохождения перво фазы закаливания, то метаболические изменения, происходящие в это время, могут быть вызваны изменением гормонального и энергетического баланса (рис. 2).
Принимая во внимание тот факт, что внеклеточное замерзание предотвращает образование внутриклеточного льда, но вызывает при этом обезвоживание макромолекулярных структур клетки, предполагается, что процесс закаливания включает в себя следующие механизмы:
- усиление оттока воды из клетки через мембраны;
- защита клеточных компонентов от действия обезвоживания.
Обеспечение оттока воды через мембраны может обеспечиваться путем повышения ненасыщенности липидов (de la Roche et. al., 1972; Smolenska, Kuiper, 1977). Изменения содержания фосфолипидов также влияют на свойства мембран и повышают их проницаемость для воды, а быстрое снижение содержания фосфолипидов при замораживании вызывает усиленны отток воды в межклетники и защищает клетку от внутриклеточного льдообразования (Касперска-Палач, 1983).
При действии мороза повреждения, вызываемые обезвоживанием у закаленных растений, могут быть предотвращены следующими путями:
- структурными и конформационными изменениями компонентов клетки, которые они претерпевают в процессе закаливания (при этом происходит как переход макромолекул в устойчивые, выдерживающие сильное обезвоживание, формы, так и индуцируемы гипотермией синтез специфических макромолекул, устойчивых к обезвоживанию);
- защитой компонентов клетки от обезвоживания взаимодействием с низкомолекулярными веществами.
Хотя и установлено, что под действием гипотермии у травянистых растений происходят изменения активности некоторых ферментов (Файзулин, Лукманова, 1987; Жибоедов и др., 1994; Makinen, Stegemann, 1981; Crespi et al., 1991), имеется относительно немного экспериментальных доказательств трансформации белковых макромолекул, которые бы вели к повышению их устойчивости к низко температуре. В то же время показано большое значение происходящего во время закаливания растений торможения роста для использования белков, синтезированных в процессе закаливания, на структурную и функциональную реорганизацию клеток (Родченко, 1988а,б).
Исследование процессов холодовой адаптации древесных растений на молекулярном уровне ограничивается наложением на процессы развития холодоустойчивости событий, связанных со входом растения в состояние покоя. R.A. Salzman с соавторами (Salzman et al., 1996), используя в качестве объекта исследования виноград (Vitis labrucana L., cv. Concord), создали систему, в которой развитие состояния покоя могло быть индуцировано отдельно от холодовой акклиматизации. С использованием это системы было охарактеризовано дифференциальное накопление ряда белков в почках винограда во время реализации программы нормального входа в состояние покоя совместно с холодовой акклиматизацие и в почках, которые входили только в состояние покоя. Было установлено, что белок с молекулярной массой 47 кДа накапливался в почках винограда во время входа в состояние покоя без холодовой акклиматизации до уровня содержания белка, обнаруженного в находящихся в состоянии покоя и закаленных почках, но не накапливался в закаленных почках, не вошедших в состояние покоя. В то же время 27 кДа LEA-подобный белок накапливался только в закаленных почках. Следовательно, 47 кДа гликопротеин является связанным с состоянием покоя, но не связанным с развитием холодовой акклиматизации, в то время как 27 кДа LEA- подобны белок, по-видимому, более специфичен для холодового закаливания (Salzman et al., 1996).
Большое значение в регуляции холодо- и морозоустойчивости растений играет абсцизовая кислота. Установлено, что при закаливании растений содержание эндогенной абсцизовой кислоты значительно возрастает, в частности, при закаливании способного к холодовой адаптации вида картофеля Solanum commersonii содержание эндогенной абсцизовой кислоты возрастало в 2,5 раза (Chen et al., 1983). У мутанта Arabidopsis thaliana, имеюшего низкий уровень содержания эндогенной абсцизовой кислоты, по сравнению с диким типом отсутствовала или была резко снижена способность к холодовой адаптации (Heino et al., 1990; Gilmor, Thomashow, 1991). В то же время обработка этого мутанта экзогенной абсцизовой кислотой приводила к появлению эффекта адаптации растений к холоду (Heino et al., 1990). При этом была показана взаимосвязь между экспрессие регулируемых холодом (COR – cold regulated) и регулируемых абсцизовой кислотой генов (Koornneef et al., 1989).
Рис. 2 Схема процессов закаливания по Касперска-Палач, 1983.
Аналогичные результаты были получены и при изучении других видов растений. Было проведено определение морозоустойчивости побегов, корней и тканей эпикотиля гороха (Pisum sativum) сорта Alaska двух генотипов: дефинитного по содержанию абсцизовой кислоты мутанта “wil” и его дикого типа при различных типах стресса (холодовая акклиматизация при +2 0 С, дегидратация/регидратация, помещение в 10 -4 М раствор абсцизовой кислоты и раззакаливании растений при 25 0 С). В ходе исследований спектры белков изучались при помощи двумерного SDS-
PAGE электрофореза. При этом было установлено, что холодовая обработка индуцировала образование семи белков в побегах, трех – в эпикотиле и двух – в корнях гороха. В тканях побегов пять из семи новых белков накапливались также в ответ на обработку абсцизовой кислотой. Полипептид с молекулярной массой 24 кДа продуцировался и в мутантных, и в «диких» проростках и тканях эпикотиля только после холодовой обработки (Welbaum et al., 1997)
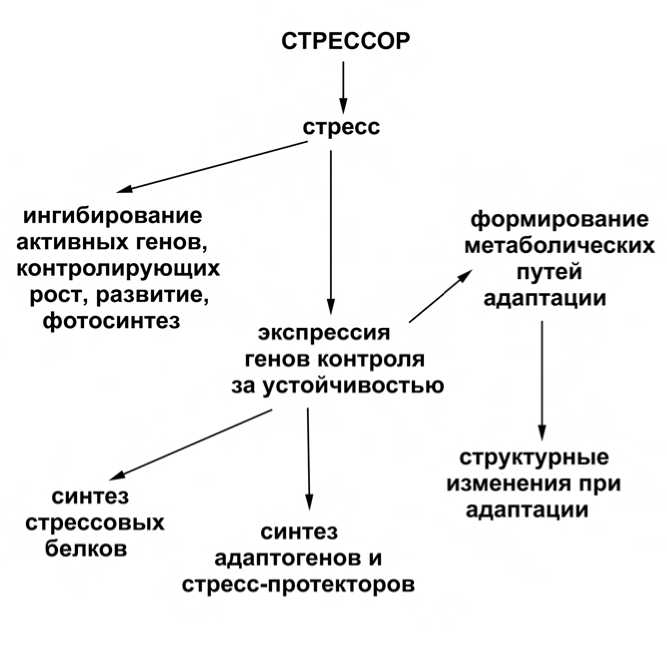
Таким образом, существенным этапом перехода от стрессовых к адаптационным реакциям является изменение экспрессии генов, выражающееся в ингибировании активных генов, в норме контролирующих рост, развитие и фотосинтез. При этом активируется система генов контроля за устойчивостью: происходит синтез новых белков, специфических адаптогенов и стресс-протекторов. Завершается эта перестройка структурными изменениями в организме растения (рис. 3) (Саляев, Кефели, 1988).
Успешное зимнее выживание вечнозеленых травянистых растений, подобных белому клеверу, зависит от соответствующей синхронизации процессов как закаливания, так и раззакаливания. Изучение регулирования этих процессов было проведено у двух сортов белого клевера (Trifolium repens L.) “AberCrest” и “AberHerald” и двух его норвежских экотипах (“Saerheim” – южном и “Bodo” – северном). Для проведения закаливания и раззакаливания растения экспонировались при контролируемых температурных условиях. Низкотемпературное закаливание столонов проводилось путем программируемого снижения температуры со скоростью 3 0 C в час. Во время эксперимента анализировались содержание крахмала, растворимых сахаров и растворимых аминокислот в столонах. Сорта AberCrest и AberHerald, происходящие из Великобритании и выбранные для контроля скорости роста при низко температуре и степени зимнего закаливания, были значительно менее устойчивы, чем норвежские популяции. После шести недель закаливания (2 недели при 6 0 C и 4 недели при 0.5 0 C) величины LT50 были: -13.8, -13.0, -17.8 и -20.3 0 C для AberCrest, AberHerald, Saerheim и Bodo, соответственно. Степень раззакаливания растений увеличивалась с повышением температуры. В условиях действия низкой температуры (6 0 C) северный экотип из Bodo был более устойчив к раззакаливанию, чем AberHerald. Тем не менее, при 18 0 C абсолютный уровень раззакаливания ( 0 С/день) у растений экотипа Bodo был в два раза выше, чем у растений AberHerald. Удлинение столонов в растениях AberHerald начиналось во время раззакаливания при более низких температурах, чем в растениях экотипа Bodo. Содержание общих растворимых сахаров, сахарозы и аминокислот пролина и аргинина было значительно выше в закаленных растениях экотипа Bodo, чем в растениях сорта AberHerald. Уровень сахарозы уменьшался в течение раззакаливания. Корреляция между содержанием сахарозы и LT50 в течение этого процесса была статистически достоверной (Svenning et al., 1997).
Установлено, что одним из криопротекторов в растениях является глицинбетаин. Это вещество накапливается в хлоропластах определенных солеустойчивых растений при солевом или холодовом стрессах. Ген codA для холиноксидазы, преобразовывающе холин в глицинбетаин, был клонирован в почвенной бактерии Arthrobacter globiformis. Трансформация Arabidopsis thaliana с клонированным геном codA под управлением 35S промотора мозаичного вируса цветной капусты позволила растению накапливать глицинбетаин и увеличить устойчивость к солевому и холодовому стрессам. Значительная часть семян трансформированных растений хорошо прорастала в 300 мМ NaCl, в то время как семена растений дикого генотипа в данных условиях не прорастали. В растворе NaCl (100 мМ) трансформированные растения хорошо росли, в то время как растения дикого типа не были способны расти в данных условиях (Hayashi et al., 1997). Трансформированные растения были способны переносить концентрацию 200 мМ NaCl, которая была летальной для растений дикого типа. После того, как растения были инкубированы в течение двух дней в растворе с повышенной концентрацией NaCl (400 мМ), активность фотосистемы II растений дикого типа была почти полностью подавлена, в то время как в трансформированных растениях она составляла более 50% от исходного уровня. После обработки растений низко температурой на свету в листьях дикого типа наблюдались симптомы хлороза, в то время как у трансформированных растений они отсутствовали. Эти наблюдения показывают, что генетическая трансформация, позволяющая накапливать глицинбетаин Arabidopsis thaliana, увеличивает способность растения переносить солевой и низкотемпературный стрессы (Hayashi et al., 1997).
Было изучено влияние низкой температуры (-2 0 С, 6 ч) на биосинтез полиаминов в листьях, стеблях и корнях разновидностей озимой пшеницы с различной морозоустойчивостью. Оказалось, что в этих условиях происходит заметное накопление полиаминов. Кроме того, обнаружен эффект 5A и 7A хромосом пшеницы, содержащих основные гены, ответственные за морозоустойчивость, на синтез полиаминов, происходящий в различных частях проростков в течение длительных периодов холодовой обработки (Rasz et al., 1996).
Рис. 3. Схема реакции растения на действие стрессового фактора (цит. по Саляев, Кефели, 1988).
Для того, чтобы определить, будет ли система in vitro подходить для изучения зимнего покоя и закаливания у древесных растений, культивируемые in vitro растения ирги ольхолистной (Amelanchier alnifolia Nutt.) были подвергнуты различной гормональной обработке, индукции
зимнего покоя и акклиматизации к низким температурам. Низкие температуры вызвали значительное повышение уровня холодоустойчивости растений (до -27 0 C после 6 недель закаливания при 4 0 C), но она не приблизилась к уровню холодоустойчивости полностью закаленных почек, которые способны переносить температуру жидкого азота. Контрольные растения в данном эксперименте полностью гибли при -5 0 C. Значительны уровень закаленности был достигнут при действии низких температур и при коротком, и при длинном дне. Предварительная обработка низко температурой при типичном для древесных растений режиме короткого фотопериода незначительно увеличила степень акклиматизации в этих растениях. Присутствие или отсутствие фитогормонов в среде имеет выраженное влияние на холодовую акклиматизацию растений. Безгормональная среда после 2 недель обработки увеличила холодоустойчивость до -10.5 0 C. Добавление в среду абсцизовой кислоты увеличило уровень холодовой закаленности (-12 0 C), в то время как добавление бензиламинопурина к безгормональной среде уменьшило закаленность до -5.3 0 C. Сочетание обработок бензиламинопурином и абсцизовой кислотой изменяло значения LT50 до промежуточных между индивидуальными обработками любым гормоном. Напротив, x-нафталенацетиловая кислота не снижала индуцированную абсцизовой кислотой закаленность. Обработка абсцизовой кислотой, как таковая, не была способна закалить растения до уровня, достигаемого при акклиматизирующем действии низкой температуры. Далее, абсцизовая кислота не могла поддерживть уровень закаленности после холодовой акклиматизации и растения деакклиматизировались до 9 0 C на среде бензиламинопурин + абсцизовая кислота. Культивирование в ней значительно увеличивало закаленность к холоду в растениях (до -9 0 C на среде бензиламинопурин + х-нафталенацетиловая кислота в течение 3 дней после культивирования), но впоследствии растения раззакаливались до – 5 0 C (Baldwin et al., 1998).
Были изучены эффекты прекультивирования с сахарами на морозоустойчивость, содержание сахаров и воды и структуру клеток концов побегов спаржи (Asparagus officinalis L.). Морозоустойчивость концов побегов повышалось после 48-часового прекультивирования на среде с высокой концентрацией сахара. Оптимальная для повышения морозостойкости концентрация сахара в середине прекультивирования была 0.5 M, независимо от типа использованного сахара. Результаты анализа содержания сахара и воды позволили считать, что обезвоживание клеток в концах побегов и поглощение сахара из среды происходило в течение прекультивирования. Было установлено, что потребленные во время прекультивирования концами побегов фруктоза, глюкоза и сахароза метаболизировались в другие типы сахаров, в то время как сорбитол нет. Предполагаемые концентрации сахаров в прекультивированных концах побегов, за исключением случая добавления сахарозы, были примерно одинаковыми в середине прекультивирования. После прекультивирования в среде с добавлением 0.5 M глюкозы, в концах побегов выживали только некоторые из меристематических выступов и листовых примордиев. Мертвые клетки, в которых органеллы были полностью уничтожены, по- видимому, были плазмолизированы в гипертоническо среде в очень значительно степени. Серьезны плазмолиз может быть последствием возможного повреждения от обезвоживания. В выживших клетках наблюдались много развитых пластид, содержащих зерна крахмала, и большое количество шероховатого эндоплазматического ретикулума, развившегося в цитозоле. Предполагается, что потребление сахаров и обезвоживание, происходящее в клетках в течение прекультивирования, связано с последующим увеличением морозоустойчивости прекультивированных концов побегов (Suzuki et al., 1997).
Известно, что многие гены вовлечены не только в процессы адаптации растений к низким температурам, но и индуцируются в ответ на другие типы стресса. Для идентификации генов, вовлеченных в защиту от стресса, вызванного воздействием тяжелых металлов, из обработанных хлоридом ртути листьев кукурузы (Zea mays L., cv. INRA 258) была создана библиотека кДНК и проведен ее анализ путем дифференциального скрининга с использованием кДНК к ДНК обработанных и необработанных хлоридом ртути растений. В результате были выделены и охарактеризованы транскрипционно активированные клоны кДНК, обозначенные CHEM (chemically-activated). Данные клоны представляют собой гены, кодирующие большое количество известных белков, таких, как белки, богатые глицином, белки, связанные с патогенезом, шапероны и мембранные белки. Экспрессия генов, кодирующих эти белки, изучена у растений кукурузы, подвергнутых разным видам абиотического стресса. При этом установлено, что экспрессия богатых глицином белков значительно увеличивается при тепловом стрессе, а также стимулируется высокой концентрацией NaCl, загрязненной дождевой водой, раневым и холодовым стрессами. Белки, связанные с патогенезом, значительно индуцируются ультрафиолетовым облучением и в меньше степени высокой концентрацией NaCl, загрязненной дождевой водой и раневым стрессом. Белки теплового шока в основном индуцируются теплом и холодом, а также убиквитином. Экспрессия мембранных канальных белков стимулируется тепловым шоком, NaCl, загрязненной дождевой водой и ультрафиолетовым облучением (Didierjean et al., 1996).
Таким образом, на основании имеющихся в литературе данных о действии на растения низкотемпературного стресса, можно сделать вывод, что, наряду с сахарами и гормонами, изменения в экспрессии генов, и, как следствие этого, изменения в содержании белков, должны играть важную роль в процессах, позволяющих клеткам выживать и функционировать при низких температурах, а накопление специфических белков с самого начала действия низкой температуры является одним из механизмов, защищающих растения от повреждения гипотермией. В связи с этим далее можно перейти к рассмотрению имеющихся в литературе данных о влиянии гипотермии на экспрессию генов, содержании белков в тканях растений и о функциях специфических (стрессовых) белков при гипотермии. Так как изменения в содержании белков во время гипотермии являются, больше частью, следствием изменения экспрессии генов, необходимо рассмотреть имеющиеся к настоящему времени данные об экспрессии генов при гипотермии.
Источник