Научная электронная библиотека
1.3. Изменения психофизиологических взаимосвязей при стрессовых состояниях
Стрессовые состояния организма представляют наиболее яркую модель психофизиологических изменений в организме. Изменения при стрессовых реакциях происходят на всех уровнях целостного организма.
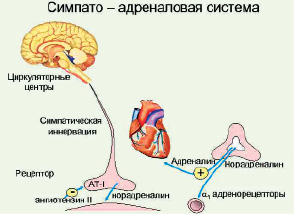
Высшая нервная деятельность иннервирует внутренние органы, гладкие мышцы, железы, кровеносные и лимфатические сосуды, осуществляет адаптационно-трофическую функцию по отношению ко всем тканям и органам (ЖКТ, мочевой пузырь, половые органы), а также регулирует АД и дыхание. Функциональное состояние симпатической и парасимпатической частей ЦНС регулирует гипоталамус. Существует тесная связь между ним и гипофизом (гипоталамо-гипофизарная система). Гипоталамус участвует в регуляции функций щитовидной железы, надпочечников, половых желез, а также процессов роста и развития. Установлено участие отдельных олигопептидов, в частности, ангиотензина II в механизмах формирования эмоциональных возбуждений [75, 76].
Симпатическая часть ВНС является важнейшим реализующим звеном всякой стресс-реакции. Она оказывает общее адаптационно-трофическое влияние на организм и участвует в запуске и развитии многофакторной стрессовой реакции [4, 137, 138]. При раздражении окончаний симпатической нервной системы усиливаются сердечные сокращения и увеличивается их ритм, возрастает скорость проведения возбуждения по мышце сердца, повышается АД и температура; нарастает содержание глюкозы в крови, необходимой для регенерации тканей; расширяются бронхи, зрачки, увеличивается секреция мозгового слоя надпочечников, снижается тонус ЖКТ. Уменьшение слюноотделения и электрического сопротивления кожи характерны для многих отрицательных эмоций. Вместе с тем в структуре этих реакций обнаруживаются признаки активации парасимпатического отдела [7, 8, 128].
И веселье, и грусть сопровождаются у человека активацией симпатической части ВНС, причем для грусти более характерны сдвиги ССС, а для веселья – изменения дыхания [31, 32].
Лицам с доминированием симпатических реакций при эмоциональном стрессе более свойственно стеническое, агрессивное поведение. Симпатические реакции усиливаются при страхе. Преобладание симпатической регуляции обеспечивает улучшение адаптивных возможностей, так как способствует генерализации нервных процессов [41, 4, 127].
Стимуляция парасимпатических нервов снижает силу и частоту сокращений сердца и АД, замедляет скорость проведения возбуждения по миокарду, увеличивает секрецию инсулина и снижает концентрацию глюкозы в крови, приводит к усилению моторной и секреторной функций ЖКТ [45].
При гневе у человека усиливаются некоторые парасимпатические реакции. Преимущественное усиление парасимпатической регуляции ухудшает адаптационные возможности. В таких случаях люди более склонны к депрессии. Степень участия симпатических и парасимпатических влияний зависит от характера данной отрицательной эмоции [88, 91, 131]. Установлена корреляция между эмоциями и физиологическими показателями (ЭЭГ, ЭКГ, содержание в крови и моче катехоламинов и кортикостероидов) [45, 46, 128].
Эмоциональная лабильность всегда связана с ВНС, что позволяет считать ее неспецифическим фактором риска возникновения хронических соматических заболеваний в подростковом возрасте. Истероидные черты на фоне выраженной лабильности, по-видимому, облегчают «соматизацию» тревожности [46, 47].
В понятие «эмоциональный стресс» включены первичные эмоциональные психические реакции, возникающие при критических психологических воздействиях, а также эмоционально-психические симптомы, вызванные травмами, аффективные реакции и физиологические механизмы [8, 9, 53, 124, 126]. Если адаптационные механизмы не справляются с возникшим напряжением, развивается состояние эмоционального (психологического) стресса – фрустрация [134].
Эмоциональный стресс развивается по следующей схеме
[126, 132, 137]: каждое сильное и сверхсильное воздействие на организм, возбуждая кору и лимбико-ретикулярную систему головного мозга, вызывает освобождение норадреналина из связанной клетками гипоталамуса формы. Действуя на адренореактивные элементы ретикулярной формации, норадреналин активирует симпатические центры головного мозга и тем самым возбуждает симпатоадреналовую систему.
Стресс-реакция создает новую нейрохимическую интеграцию в лимбико-ретикулярных мозговых структурах [133, 134]. Под влиянием нейромедиаторов в гипофизарно-ретикулярных образованиях увеличивается продукция гормонов и, как следствие, изменяется функциональное состояние эндокринных желез [38]. Эти сдвиги лежат в основе пластических перестроек эмоционального возбуждения при длительных стресс-реакциях и создают основу для перехода стресса в устойчивую, стационарную форму [40, 125, 126].
После травм и в процессе уравнивания длины конечностей, как и любом другом эмоциональном стрессе, могут изменяться нейрохимические свойства мозга, состояние его молекулярных структур, которые фиксируются специальными олигопептидами и могут сохраняться длительное время – месяцы и годы. В силу этого появляется чувство неудовлетворенности, большой внутренней напряженности, плохое настроение, постоянное раздражение, тревожность, страх, гнев, негодование, чувство вины, неизгладимой тоски и депрессии [103]. Если психолог постоянно не работает с больным, то недостаточность психологической защиты открывает дорогу физиологическим и биохимическим факторам патогенеза заболе-
вания [103, 105].
Благодаря генерализованному распространению через соматическую и вегетативную нервную системы и гормональный гипоталамо-гипофизарный механизм, отрицательные эмоции оказывают влияние практически на все ткани организма, формируя тем самым системные реакции стресса [2-4, 104, 126].
Взаимосвязь между результатами психологических тестов и конкретными нейро-химическими показателями обусловлена особенностями функционирования различных отделов центральной нервной системы (кора головного мозга, ретикулярная формация, гипоталамус, лимбическая система и др.) [139]. Она подтверждается, в частности, на примере неврозов (моделей хронического эмоционального стресса) различиями в концентрациях биологически активных веществ, участвующих в реакциях стресса, и характером электрической активности коры головного мозга [8, 9]. При действии на организм стрессоров у больных с нарушениями функционального состояния коры надпочечников и других эндокринных органов возникает диссоциация ретикуло-таламо-кортикального взаимодействия. Наступают изменения в симпатическом и парасимпатическом отделах вегетативной нервной системы.
В характере развертывания эмоционального стресса, в частности, таких важных его звеньев, как нейро-гормональные, выявляется роль личности, причем центральное место занимает степень выраженности таких чрезвычайно существенных свойств, как истерические, ипохондрические, нейротизм, склонность к тревожности и пониженному настроению, фрустрации, интраверсии-экстраверсии, вербальный и невербальный интеллект [18-20, 126, 137]. Это позволяет предсказать возможную выраженность нейро-гормональных изменений у больных, жизнь которых длительное время протекала в экстремальных условиях. При стрессе, возникшем в результате помещения больного в стационар, происходит статистически достоверно увеличение 11-ОКС и серотонина. Биохимические изменения отражают состояние гипофизарно-адреналовой и симпато-адреналовой систем [20-23, 137, 139].
Нарастающее эмоциональное напряжение разряжается по вегетативным проводникам, что ведет к возникновению функциональных нарушений внутренних органов. Вызванная при стрессе физиологическим путем дезорганизация находит отражение в наиболее «слабой» системе, например, в ЖКТ, сердце и т.д. В случае подавления выражения эмоций создается картина наиболее тяжелых расстройств с развитием органических заболеваний внутренних органов [37, 43, 138].
Угнетение высшей нервной деятельности сопровождается снижением поглотительной функции элементов соединительной ткани, возбуждение – стимуляцией этих функций [53].
Источник
Научная электронная библиотека
Тапбергенов С. О., Тапбергенов Т. С., Советов Б. С.,
3. Стресс и симпато-адреналовая система
Многочисленными исследованиями установлено, что роль пускового фактора во многих реакциях организма, в ответ на действие разнообразных агентов, играют гормоны мозгового вещества надпочечников, выполняющие одновременно роль медиаторов симпато-адреналовой системы. Экстренное выделение катехоламинов при действии внешних стимулов есть первое проявление стресса.
Согласно представлениям И.П. Павлова, реакция организма на чрезвычайное разражение и возникающие при этом повреждения органов, являются результатом нарушения трофики, вызываемых чрезмерной нервной импульсацией. На основании многочисленных исследований Л.А. Орбели построил теорию об адаптационно-трофической функции симпатической нервной системы. «С одной стороны, она (симпатическая нервная система) изменяет функциональные свойства, адаптация, с другой – вызывает существенные химические, физико-химические и физические сдвиги (трофики)» – Л.А. Орбели (1962).
Рис. 8. Симпато-адреналовая система
Целым рядом исследований показано, что возбуждение симпато-адреналовой системы, сопровождаемое мобилизацией катехоламинов, является одной из ранних реакций организма на лучевое воздействие и свидетельствует о пусковой роли гормонов мозгового вещества в реакциях адаптации (В.С. Даниленко и др., 1970, Г.М. Мусагалиева и др., 1988).
Известно (А.М. Бару, 1968,), что увеличение или уменьшение коэффициента А/НА отражает степень активности периферического, либо центрального отдела симпато-адреналовой системы (САС). Установлено, что стресс может привести к нарушениям механизмов адаптационных реакций, к истощению медиаторного звена симпато-адреналовой системы.
Наблюдаемая при стрессе активация симпато-адреналовой системы носит компенсаторный характер и происходит за счет гуморального звена. Повышенная экскреция катехоламинов при стрессе также указывает на значительную активацию симпато-адреналовой системы.
Активация симпато-адреналовой системы при хирургическом стрессе вызывает нарушения гемодинамики, особенно эти нарушения выражены у больных с облитерирующими заболеваниями сосудов, у которых отмечаются снижение сердечного и ударного индексов, повышение общего периферического сопротивления сосудов.
Вместе с тем, активация симпато-адреналовой системы с относительным преобладанием гормонального звена в ближайшем послеоперационном периоде рассматривается как одно из неблагоприятных проявлений постишемического периода.
Длительно существующие высокие концентрации катехоламинов в крови отрицательно влияют на микроструктуру миокарда, вызывают аритмию, резко увеличивают содержание циклических нуклеотидов в клетках сердечной мышцы (Podzweit I. et al., 1981). Ежедневное, в течение 6 недель введение адреналина в дозе 100 мкг/кг веса вызывает изменения обмена веществ и функции органов, характерные для состояния длительной физической тренировки.
Установлено, что токсические дозы катехоламинов могут способствовать развитию аритмий (П.Ф. Литвицкий, 1979), уменьшению эффективности механической работы, повышению потребления кислорода, гипоксемии и развитию феномена «кислородной утечки» (М.Е. Райскина и др., 1963, И.В. Голубева, 1972, Opie L.H. et al., 1979).
Это действие катехоламинов сопровождается сменой прессорных влияний на депрессорные и вызвана стимуляцией бета2-адренорецепторов и может быть предотвращена введением кальция и бета-адреноблокадой (Opie L.H. et al., 1979). Введение токсических доз катехоламинов приводит к некротическим изменениям, воспалению и фибринозному перерождению миокарда (Haft J.I., 1973), нарушению структуры митохондрий (К.С. Митин и др., 1975).
Защитным действием к катехоламиновым некрозам миокарда обладают бета-адренолокаторы (В.В. Малышев и др., 1986 Kulig A. et al., 1973) и антиоксиданты типа витамина Е и этанол. Положительный эффект бета-адреноблокаторов наблюдается и при остром инфаркте миокарда (Edoute Y et al., 1981) и при нейрогенных поражениях миокарда, вызванных трехчасовой электростимуляцией дуги аорты (И.С. Заводская и др., 1977).
Большой цикл исследований по проблеме влияния стресса на кровообращение человека провели P. Obrist (1985) и Е.В. Белова (1987). Согласно этим работам, при стрессе характерно увеличение ЧСС, повышение минутного обьёма кровобращения (МОК) и систолического АД, при отсутствии повышения общего периферического сопротивления сосудов (ОПС), а при корректурной пробе – увеличение ОПС и диастолического АД, без повышения МОК.
В других работах (Б.М. Федоров, 1991) отмечено, что во время стрессового воздействия при напряженной умственной работе показатели кровообращения в различных случаях изменяются не однотипно. В ряде наблюдений вначале отмечается снижение ОПС сосудов и увеличение МОК. По мере нарастания стрессорной реакции характер изменений системной гемодинамики существенно изменялся. При этом снижение тонуса сосудов большого круга кровообращения сменяется его повышением. Соответственно более резко повышается АД и менее значительно повышается или даже снижается МОК.
В стрессорных ситуациях изменяется сердечная деятельность, состояние артериальных и венозных сосудов, микрогемоциркуляция. Учащение сердечных сокращений лишь до определенного предела отражает выраженность стрессорной реакции.
Нарушения кровообращения четко коррелируют с динамикой стрессорных реакций. Влияние стрессов на кровообращение на микроциркуляторном уровне выражается в констрикции артериол, появлением агрегатов эритроцитов, нарушением сосудистой проницаемости, замедлением кровотока в венах, а затем в артериолах, возникновением стазов.
Установлено, что изменения активности симпатической нервной системы, общего периферического сопротивления сосудов и среднего артериального давления в ходе хирургического стресса имеют однонаправленный характер (Т.С. Тапбергенов, 1992).
При психоэмоциональном стрессе отмечено изменение реологических свойств крови, в частности, увеличение ее вязкости и проницаемости стенок венулярных сосудов.
Как показано исследованиями Т.С. Тапбергенова (1992), при хирургическом стрессе степень выраженности изменений показателей вегетативной регуляции и центральной гемодинамики зависят от исходного состояния каждого из них и этапа оперативного вмешательства. При исходно высоком тонусе симпатического отдела вегетативной нервной системы его влияние на среднее артериальное давление и тонус сосудов компенсирует, ожидаемое в начале операции, угнетение сердечно-сосудистой системы, а исходно низкая симпатическая активность вегетативной регуляции усугубляет гемодинамические нарушения в ходе хирургического вмешательства.
В происхождении различных вариантов изменений гемодинамики в стрессорных и экстремальных ситуациях существенное значение имеют изменения венозного возврата крови к сердцу. Так развитие прессорной реакции, вызванной введением катехоламинов, в начальном периоде связано с изменениями тонуса артерий и соответственно повышением общего периферического сопротивления.
При дальнейшем развитии прессорной реакции, вызванной катехоламинами, характерно повышение роли венозного возврата в формировании величины сердечного выброса. Роль этих изменений в поддержании высоких показателей АД становится весьма существенной, составляя до 50 % вклада в реализацию эффекта гипертензии (Б.Я. Зонис, 1986). Давление в венах, состояние окружающих их тканей, в частности скелетных мышц, и особенно симпатическая стимуляция венозного тонуса, чувствительность альфа-адренорецепторов, обеспечивающих констрикторные эффекты – все это отражается на изменении просвета сосудов, емкости венозного русла и возврате крови к сердцу.
Показана возможность в условиях патологии значительного увеличения объёма вен и задержки в них крови при сочетании повышенного давления в растянутых венах с адренергической стимуляцией венозных «сфинктеров», расположенных в области венозных клапанов. При стрессорных воздействиях возникновение коллаптоидных состояний может быть следствием резкого снижения возврата венозной крови к сердцу. Повышение тонуса венозных сосудов и увеличение венозного возврата рассматривается как существенный фактор в патогенезе гипертонии.
Анализ результатов реакции торможения миграции лимфоцитов (РТМЛ) с митогеном конкавалином А (Соn A) в присутствии различных концентраций норадреналина, позволяющей оценить чувствительность адренорецепторов (В.Р. Вебер, 1992), показал, что на разных этапах хирургического стресса имеет место снижение индекса чувствительности адренорецепторов лимфоцитов к норадреналину (табл. 1).
Индекс торможения миграции лимфоцитов при хирургическом стрессе (на 100 клеток, М ± m)
Источник