- Нейроэндокринные системы при стрессе
- Нейроэндокринные синдромы
- Предменструальный синдром
- Климактерический синдром
- Синдром поликистозных яичников
- Адреногенитальный синдром
- Посткастрационный синдром
- Публикации в СМИ
- Нейрогенез во взрослом мозге: влияние стресса и депрессии
- Код вставки на сайт
- Нейрогенез во взрослом мозге: влияние стресса и депрессии
Нейроэндокринные системы при стрессе
В последнее десятилетие появляется все больше данных, подтверждающих возможность как позитивного, так и негативного эффектов стресса на защитные функции организма. Одним из основных механизмов развития дисфункций иммунной системы при тяжелом стрессе и ряде отягощенных стрессом заболеваний является нарушение взаимодействия нейроэндокринной и иммунной систем [3, 5, 9]. Выявление природы этих нарушений открывает новые возможности для адресного воздействия с целью их коррекции и, таким образом, лечения стресс-обусловленных заболеваний.
Потенциал защитных функций организма в значительной степени определяется уровнем активности клеток иммунной системы, включающим интенсивность пролиферации лимфоцитов при действии цитокина интерлейкина-1b (ИЛ-1b) и уровень цитотоксической активности естественных киллерных (ЕК) клеток, являющихся первым барьером на пути развития инфекционных и онкологических заболеваний [4, 8].
Анализ функциональных резервов иммунокомпетентных клеток в совокупности с другими показателями активности защитных функций, таких как активность гипоталамо-гипофизарно-адренокортикальной (ГГАКС) и гипоталамо-гипофизарно-гонодальной (ГГГС) систем организма, позволяет раскрыть механизмы их нарушений при различных дестабилизирующих воздействиях, в том числе при стрессе. Изменение концентраций в крови кортикостерона и тестостерона — гормонов, отражающих активность ГГАКС и ГГГС, соответственно — рационально также использовать в качестве показателей стрессорной реакции.
Одним из потенциальных корректоров нарушенных защитных функций является лекарственный препарат Деринат (АО ФП «Техномедсервис», Москва) — натриевая соль нативной ДНК с молекулярной массой 270-500 kDa, получаемая из молок лососевых или осетровых рыб, обладающая радиопротекторной, противовирусной, регенеративной активностью [1, 2].
Целью работы явилось исследование изменения цитотоксической и пролиферативной активности спленоцитов, концентрации глюкокортикоидных гормонов и тестостерона в крови крыс, подвергнутых действию холодового стресса в различных режимах, а также определение способа их коррекции с помощью препарата Деринат.
Материалы и методы исследования
Эксперименты выполнены на 89 крысах-самцах Wistar массой 200-220 г. Деринат, растворенный в 0,15 М NaCl, вводили животным однокpатно, в/бр в дозе 10 мг/кг массы.
В работе использованы две модели экспериментального стресса: холодовой стресс (охлаждение крыс в индивидуальных металлических контейнерах в течение 10 мин при -20 °С) и комбинированный стресс (охлаждение животных, фиксированных на спине, в течение 30 мин при -20 °С).
Экспериментальные группы животных:
При оценке цитотоксической активности ЕK клеток селезенки в качестве мишеней для них использовали клетки эритромиелолейкоза человека К-562 (Институт Цитологии РАН, Санкт-Петербург), которые метили 3 Н-уридином («Изотоп», Россия). Реакцию между клетками-эффекторами и клетками-мишенями учитывали по уровню 3 Н-уридина в нелизированных клетках-мишенях в течение 1 мин (c.p.m.) при использовании β-счетчика (Beckman).
Определение интенсивности реакции бласттрансформации спленоцитов (РБТС) осуществляли общепринятым методом [8] при внесении в суспензию клеток Кон А (Sigma, 0,75 мкг/мл) и рекомбинантного ИЛ-1β (Sigma) со специфической активностью 1,0∙10 7 ед/мг белка в дозе 250 нг/мл. Оценку включения H 3 -тимидин в ДНК делящихся клеток проводили на β-счетчике.
Концентрацию кортикостерона и тестостерона в крови определяли иммуноферментным методом с использованием реактивов Хема-Медика (РФ).
Статистическая обработка результатов проведена по критерию t Стьюдента.
Результаты исследований и их обсуждение
Через 1 ч после окончания 10-минутного холодового стресса в крови крыс наблюдалось увеличение концентрации кортикостерона и снижение уровня тестостерона по сравнению с этим показателем у нестрессированных животных. Более интенсивное комбинированное 30-минутное воздействие также приводило к повышению уровня кортикостерона в крови через 1 ч с последующим возвращением к нормальным значениям через 24 ч и снижению концентрации тестостерона в оба регистрируемых срока (табл. 1). Полученные данные демонстрируют развертывание стрессорной реакции у животных при обоих видах воздействия.
Таблица 1 Изменение концентраций кортикостерона и тестостерона в сыворотке крови крыс после введения Дерината в дозе 10 мг/кг массы и аппликации стресса различной интенсивности
Сроки после введения Дерината и аппликации стресса
Контрольные (введение 0,15 М NaCl)
Деринат (10 мг/кг массы)
Контроль + стресс 10 мин
Деринат + стресс 10 мин
Контроль + стресс 30 мин
Деринат + стресс 30 мин
* — р 3 H-тимидина в ДНК делящихся спленоцитов в результате комитогенного действия ИЛ-1β в присутствии Кoн А (см. табл. 2). Установлено, что 10-минутное охлаждение вызывает интенсификацию РБТС при инкубации клеток с Кон А, а также Кон А совместно с ИЛ-1β через 24 ч после окончания стрессорного воздействия по сравнению с уровнем этой реакции у интактных животных (см. табл. 2). Введение Дерината за 20 мин до аппликации 10-минутного стресса не приводило к изменению интенсивности РБТС (см. табл. 2). Комбинированное 30-минутное воздействие на крыс через 24 ч после его окончания вызывало снижение уровня РБТС. Инъекция Дерината до аппликации 30-минутного стресса через 24 ч восстанавливала интенсивность включения метки в нестимулированные лимфобласты, а также при их стимуляции Кон А и ИЛ-1β (см. табл. 2). Таким образом, введение Дерината приводило к усилению реакции спленоцитов крыс, подвергнутых 30-минутному комбинированному воздействию, на комитогенное действие ИЛ-1β и, следовательно, препятствовало стресс-индуцированному угнетению пролиферативной активности клеток.
Результаты исследований позволяют заключить, что стресс-обусловленные изменения функциональной активности иммунокомпетентных клеток зависят от интенсивности стрессорного воздействия: 10-минутное охлаждение крыс приводит к стимуляции специфической цитотоксичности и пролиферативной активности спленоцитов в ответ на комитогенное действие ИЛ-1β через 24 ч после окончания стрессорного воздействия, а интенсивное 30-минутное холодовое воздействие в сочетании с иммобилизацией животных вызывает снижение этих показателей. Изменение уровня гормонов в крови, наоборот, не зависит от вида воздействия: на обеих моделях стресса показано повышение уровня кортикостерона и снижение концентрации тестостерона в крови животных. Полученные результаты соответствуют данным литературы о контрфазном характере изменения содержания этих гормонов в крови при стрессе: повышение концентрации кортикостерона сопровождается снижением уровня тестостерона, которые реализуются на уровне гипофиза и имеют адаптивное значение [10].
При аппликации стресса на фоне введения препарата нативной ДНК Деринат установлено его стресс-протективное действие, проявляющееся в предотвращении снижения концентрации тестостерона в крови.
После введения Дерината в дозе 10 мг/кг цитотоксическая активность ЕК клеток селезенки, повышенная в условиях кратковременного стрессорного воздействия, снижается практически до нормы, а в случае ее угнетения, вызванного жестким комбинированным стрессом, она восстанавливается также до нормальных значений. Введение Дерината препятствует стресс-индуцированному угнетению пролиферативной активности спленоцитов, вызывая нормализацию реакции клеток на комитогенное действие ИЛ-1β. Таким образом, Деринат, расщепляющийся в клетках организма до нуклеотидов, которые после выделения во внеклеточную среду связываются с пуринергическими Р2 рецепторами [6, 7], обладает не только стресс-протективными эффектами, но и оказывает нормализующее действие на стресс-индуцированные изменения некоторых функций иммунной системы.
Полученные экспериментальные данные согласуются с результатами клинических наблюдений [1, 2], в которых показано корригирующее влияние препаратов нуклеотидной природы при нарушениях, обусловленных как ослаблением функций иммунной системы, так и избыточной их активностью.
Источник
Нейроэндокринные синдромы
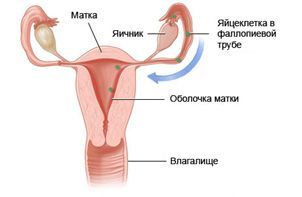
Работа женской репродуктивной системы регулируется двумя железами, расположенными в головном мозге: гипоталамусом и гипофизом. Они выделяют гормоны, которые оказывают влияние на половые железы, заставляя их работать более или менее интенсивно.
Патологические состояния, обусловленные нарушением функции гипофиза и гипоталамуса, называют нейроэндокринными синдромами.
Основные нейроэндокринные синдромы:
- Предменструальный синдром
- Климактерический синдром
- Синдром поликистозных яичников
- Адреногенитальный синдром
- Посткастрационный синдром
- Стоимость первичной консультации — 3 000
- Стоимость консультации с УЗИ — 4 200
Записаться на прием
Предменструальный синдром
Предменструальный синдром представляет собой совокупность психологических, нервных и эндокринных нарушений, которые возникают перед месячными и проходят или уменьшаются во время менструации. Синдром встречается примерно у 2 – 30% женщин репродуктивного возраста. Тяжелее всего протекает после 35 лет.
Симптомы очень разнообразны.
Основные проявления:
- повышенная возбудимость, раздражительность,
- подавленное состояние, депрессия,
- головные боли, головокружения,
- боли в области сердца, резкое падение или повышение артериального давления,
- прибавка массы тела,
- отеки на лице и руках,
- аллергические реакции, зуд кожи, сыпь.
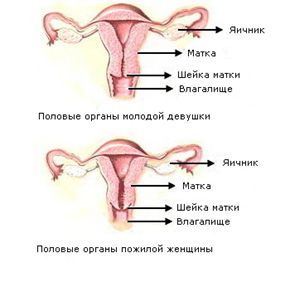
Климактерический синдром
Климактерический синдром – это симптомокомплекс, возникающий в связи с прекращением менструаций. Как правило, развивается у женщин в возрасте 48 – 50 лет. Основная причина – возрастная перестройка гормональной системы, переход от репродуктивного к старческому возрасту.
Основные симптомы и проявления:
- головные боли, головокружения, «приливы»;
- повышения артериального давления, приступы учащенного сердцебиения;
- изменения настроения, нарушение сна;
- сухость кожи, потливость, ознобы, онемения и покалывания в разных частях тела, чувство «ползания мурашек»;
- остеопороз;
- боли в суставах, мышцах;
- увеличение размеров молочных желез;
- сахарный диабет II типа;
- рассеянность, повышенная утомляемость, снижение работоспособности.
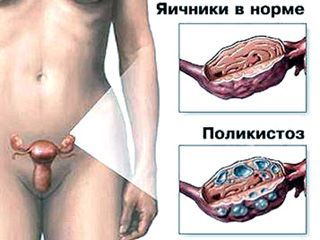
Синдром поликистозных яичников
Синдром поликистозных яичников – патологическое состояние, при котором в организме женщины вырабатывается повышенное количество мужских половых гормонов – андрогенов.
Основными симптомами заболевания являются: аменорея (отсутствие месячных), бесплодие, повышенное оволосение (по мужскому типу), ожирение.
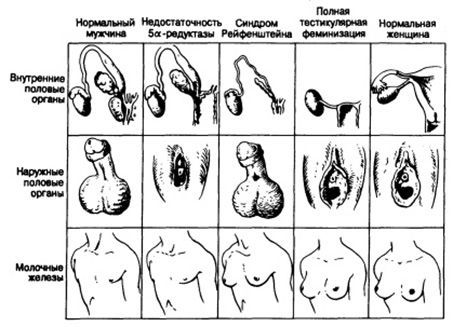
Адреногенитальный синдром
Адреногенитальный синдром возникает вследствие нарушения функции надпочечников и проявляется в виде вирилизации – развития мужских признаков.
В зависимости от происхождения, выделяют две формы адреногенитального синдрома:
- Врожденный. Возникает в результате наследственных нарушений. Проявляется в виде изменения наружных половых органов по мужскому типу. Иногда в родильном доме пол ребенка определяют ошибочно как мужской.
- Приобретенный. Является следствием чрезмерного развития коры надпочечников или (реже) её опухолей. У девочки развиваются мужские черты. Отсутствуют менструации, уменьшаются в размерах молочные железы, отмечается телосложение по мужскому типу, рост волос на лице и в других нехарактерных местах.
Посткастрационный синдром
Возникает после операции удаления яичников (кастрации). При этом в организме полностью прекращается выработка женских половых гормонов – эстрогенов.
Основные симптомы:
- частые приливы;
- повышенная утомляемость, снижение трудоспособности;
- головные боли, нарушения сна;
- раздражительность;
- снижение памяти и внимания;
- потливость;
- учащенное сердцебиение, подъемы артериального давления;
- ожирение, повышение уровня холестерина крови, атеросклероз;
- остеопороз.
Источник
Публикации в СМИ
Нейрогенез во взрослом мозге: влияние стресса и депрессии
Головной мозг – основной орган, реагирующий на стресс. Эта реакция является комплексным, очень сложным процессом, в котором происходит как активация, так и подавление различных мозговых структур, связанных с формированием памяти, осуществлением двигательных, эмоциональных и когнитивных функций.
Мозг определяет, какие ситуации и события могут оказаться для человека стрессорными, и его ответ на стресс может быть как адаптивным, так и маладаптивным (адекватным либо неадекватным). Хронический стресс приводит к депрессии, которая в свою очередь вызывает повреждения нейронных сетей. Стресс, производимый окружающей средой (стресс на работе, в семье) и в особенности стрессирующие события в жизни, такие как психологические травмы – наиболее распространенные факторы, вызывающие депрессию. Поскольку разработка новых подходов к созданию антидепрессантов и их применению базируется на более глубоком понимании нейробиологических основ этого процесса, необходимо изучение влияния стресса и депрессии на клеточном уровне.
Депрессия является хроническим, рецидивирующим, имеющим множественную этиологию и опасным для здоровья и жизни состоянием, которая представляет из себя набор психологических, нейроэндокринных, физиологических и поведенческих симптомов. Выраженность этих симптомов определяет степень депрессии, которой в те или иные моменты жизни подвергаются до 20% людей во всем мире. Около 20-50% населения земного шара страдают от депрессии, но часто это состояние неверно диагностируют (Wittchen, 2000).
Депрессивные психические расстройства – наиболее распространенное заболевание в мире, провоцирующее серьезные социоэкономические проблемы (WHO, 2001). По прогнозам, к 2015 году депрессия окажется второй после сердечнососудистых заболеваний причиной недееспособности среди европейцев.
Зоны мозга, наиболее сильно страдающие от депрессии – это зоны, отвечающие за формирование эмоций, за процессы обучения и памяти, а именно префронтальная кора, базальные ядра и гиппокамп. Изменения, происходящие в них, включают уменьшение объема структур, размеров нейронов и их плотности, что связано с нарушениями гемодинамики и метаболизма глюкозы. Также снижается количество клеток глии, которые играют ключевую роль в передаче нервного импульса.
Так называемая «стресс-гипотеза» аффективных психических расстройств подтолкнула разработку моделей депрессии на животных. Эти модели стали незаменимы в доклинических исследованиях по психопатологии, патофизиологии депрессии и специфических реакций на антидепрессанты. Открытие того, что в дефинитивной нервной системе продолжаются процессы нейрогенеза, привлекло в свое время большой интерес научного сообщества, так как до этого нейрональные сети взрослого мозга считались неизменными и неспособными к регенерации. Эта аксиома была в 1928 году высказана известным испанским нейрофизиологом Сантъяго Рамоном и Кайялом (Santiago Ramon y Cajal), который в одной из работ написал про нервную ткань: «здесь все может погибнуть, но ничто не способно восстанавливаться» (Cajal, 1928). Современные исследования опровергли этот взгляд, продемонстрировав формирование новых нейронов (нейрогенез) во взрослом мозге. При этом процессы нейрогенеза могут усиливаться позитивными регуляторами и подавляться негативными, такими как острый и хронический стресс.
В то время как стресс ингибирует нейрогенез в гиппокампе, антидепрессанты имеют противоположный эффект. Более того, пациенты с расстройствами эмоциональной сферы в среднем имеют гиппокамп с меньшими средними размерами, чем у здоровых людей. Когда об этом стало известно, это привело к возникновению «нейрогенной гипотезы» депрессии, которая гласит, что нейрогенез в гиппокампе, а точнее его нарушения, могут оказаться первопричиной развития депрессивных расстройств. Однако, согласно сегодняшнему взгляду на эту проблему, нейрогенез в гиппокампе не играет ключевой роли в патогенезе депрессии, хотя и может быть ответственен за некоторые поведенческие эффекты антидепрессантов (Sahay & Hen, 2007).
Также растет количество данных о том, что, помимо воздействия на нейрогенез, стресс и антидепрессанты оказывают влияние на формирование специфических клеток нервной ткани – глии (глиогенез), необходимых для выживания нейронов. Нервная ткань содержит примерно в 100 раз больше глиальных клеток, чем нейронов. Глия выполняет трофическую функцию и принимает участие в регуляции передачи нервных импульсов через синапсы (контакты между отростками нервных клеток). Глиальные клетки также обладают рецепторами к нейротрансмиттерами и стероидным гормонам и способны к генерации электрических импульсов. По этой причине структурные изменения в глиальных клетках могут быть существенны для обмена информацией между нейронами, а также между нейронами и глией.
Во взрослом мозге терапия различными антидепрессантами может стимулировать не только нейрогенез, но и глиогенез. Более того, исследования на животных показали, что хронический стресс подавляет деление клеток не только в гиппокампе, но также и в префронтальной коре, и что этот эффект может быть отменен антидепрессантами (Czeh et al., 2007). Результаты эти были подтверждены исследованиями пациентов с расстройствами эмоций. С помощью компьютерной томографии было показано, что префронтальная кора, несомненно, вовлечена в патофизиологические процессы. В дальнейшем была проведена оценка состояния тканей умерших пациентов, показавшая, что число глиальных клеток в образцах мозга от пациентов, в анамнезе которых была указана тяжелая депрессия, существенно снижено.
В последние два десятилетия представления о мозге сильно изменились. Теперь ясно, что нейрональные и глиальные сети не неизменны, и находятся под контролем множества факторов, таких как факторы внешней среды (например, обучение), и внутренние факторы: нейротрофины, глюкокортикоиды, половые гормоны, и проч. Антидепрессанты стимулируют нейро- и глиогенез, поэтому структурные повреждения, вызванные стрессом и депрессией, не являются необратимыми.
Сегодня считается, что нейрогенез во взрослом мозге ограничен несколькими зонами: гиппокампом и областями, прилегающими к латеральным мозговым желудочкам. Однако появляется все больше данных о том, что образование новых нейронов происходит также в неокортексе. Несмотря на небольшое число этих клеток, они имеют важное значение для функционирования неокортекса. Взаимосвязь психических заболеваний и цитогенеза в дефинитивном неокортексе пока не ясна, но уже ведутся ее доклинические исследования. Возможно, на основе этих работ будут созданы более эффективные подходы к лечению депрессии.
Wittchen HU, Hoefler M, Meister W. Depressionen in der Allgemeinpraxis. Die bundesweite Depressionsstudie. Stuttgart: Schattauer, 2000
Moussavi S, Chatterji S, Verdes E, et al. Depression, chronic diseases, and decrements in health: results from the World Health Surveys. Lancet 2007;370:851-858
World Health Organisation (WHO). The World Health Report 2001. Mental Health: New Understanding, New Hope. Download http://www.who.int/whr/2001/en/whr01_en.pdf
Sahay A, Hen R. Adult hippocampal neurogenesis in depression. Nature Neuroscience 2007;10:1110-1115
Ramon y Cajal, SR. Degeneration and regeneration of the nervous system. London, Oxford University Press, 1928
Czeh B, Mueller-Keuker JIH, Rygula R, et al. Chronic social stress inhibits cell proliferation in the adult medial prefrontal cortex: hemispheric asymmetry and reversal by fluoxetine treatment. Neuropsychopharmacology 2007;32:1490-1503
Код вставки на сайт
Нейрогенез во взрослом мозге: влияние стресса и депрессии
Головной мозг – основной орган, реагирующий на стресс. Эта реакция является комплексным, очень сложным процессом, в котором происходит как активация, так и подавление различных мозговых структур, связанных с формированием памяти, осуществлением двигательных, эмоциональных и когнитивных функций.
Мозг определяет, какие ситуации и события могут оказаться для человека стрессорными, и его ответ на стресс может быть как адаптивным, так и маладаптивным (адекватным либо неадекватным). Хронический стресс приводит к депрессии, которая в свою очередь вызывает повреждения нейронных сетей. Стресс, производимый окружающей средой (стресс на работе, в семье) и в особенности стрессирующие события в жизни, такие как психологические травмы – наиболее распространенные факторы, вызывающие депрессию. Поскольку разработка новых подходов к созданию антидепрессантов и их применению базируется на более глубоком понимании нейробиологических основ этого процесса, необходимо изучение влияния стресса и депрессии на клеточном уровне.
Депрессия является хроническим, рецидивирующим, имеющим множественную этиологию и опасным для здоровья и жизни состоянием, которая представляет из себя набор психологических, нейроэндокринных, физиологических и поведенческих симптомов. Выраженность этих симптомов определяет степень депрессии, которой в те или иные моменты жизни подвергаются до 20% людей во всем мире. Около 20-50% населения земного шара страдают от депрессии, но часто это состояние неверно диагностируют (Wittchen, 2000).
Депрессивные психические расстройства – наиболее распространенное заболевание в мире, провоцирующее серьезные социоэкономические проблемы (WHO, 2001). По прогнозам, к 2015 году депрессия окажется второй после сердечнососудистых заболеваний причиной недееспособности среди европейцев.
Зоны мозга, наиболее сильно страдающие от депрессии – это зоны, отвечающие за формирование эмоций, за процессы обучения и памяти, а именно префронтальная кора, базальные ядра и гиппокамп. Изменения, происходящие в них, включают уменьшение объема структур, размеров нейронов и их плотности, что связано с нарушениями гемодинамики и метаболизма глюкозы. Также снижается количество клеток глии, которые играют ключевую роль в передаче нервного импульса.
Так называемая «стресс-гипотеза» аффективных психических расстройств подтолкнула разработку моделей депрессии на животных. Эти модели стали незаменимы в доклинических исследованиях по психопатологии, патофизиологии депрессии и специфических реакций на антидепрессанты. Открытие того, что в дефинитивной нервной системе продолжаются процессы нейрогенеза, привлекло в свое время большой интерес научного сообщества, так как до этого нейрональные сети взрослого мозга считались неизменными и неспособными к регенерации. Эта аксиома была в 1928 году высказана известным испанским нейрофизиологом Сантъяго Рамоном и Кайялом (Santiago Ramon y Cajal), который в одной из работ написал про нервную ткань: «здесь все может погибнуть, но ничто не способно восстанавливаться» (Cajal, 1928). Современные исследования опровергли этот взгляд, продемонстрировав формирование новых нейронов (нейрогенез) во взрослом мозге. При этом процессы нейрогенеза могут усиливаться позитивными регуляторами и подавляться негативными, такими как острый и хронический стресс.
В то время как стресс ингибирует нейрогенез в гиппокампе, антидепрессанты имеют противоположный эффект. Более того, пациенты с расстройствами эмоциональной сферы в среднем имеют гиппокамп с меньшими средними размерами, чем у здоровых людей. Когда об этом стало известно, это привело к возникновению «нейрогенной гипотезы» депрессии, которая гласит, что нейрогенез в гиппокампе, а точнее его нарушения, могут оказаться первопричиной развития депрессивных расстройств. Однако, согласно сегодняшнему взгляду на эту проблему, нейрогенез в гиппокампе не играет ключевой роли в патогенезе депрессии, хотя и может быть ответственен за некоторые поведенческие эффекты антидепрессантов (Sahay & Hen, 2007).
Также растет количество данных о том, что, помимо воздействия на нейрогенез, стресс и антидепрессанты оказывают влияние на формирование специфических клеток нервной ткани – глии (глиогенез), необходимых для выживания нейронов. Нервная ткань содержит примерно в 100 раз больше глиальных клеток, чем нейронов. Глия выполняет трофическую функцию и принимает участие в регуляции передачи нервных импульсов через синапсы (контакты между отростками нервных клеток). Глиальные клетки также обладают рецепторами к нейротрансмиттерами и стероидным гормонам и способны к генерации электрических импульсов. По этой причине структурные изменения в глиальных клетках могут быть существенны для обмена информацией между нейронами, а также между нейронами и глией.
Во взрослом мозге терапия различными антидепрессантами может стимулировать не только нейрогенез, но и глиогенез. Более того, исследования на животных показали, что хронический стресс подавляет деление клеток не только в гиппокампе, но также и в префронтальной коре, и что этот эффект может быть отменен антидепрессантами (Czeh et al., 2007). Результаты эти были подтверждены исследованиями пациентов с расстройствами эмоций. С помощью компьютерной томографии было показано, что префронтальная кора, несомненно, вовлечена в патофизиологические процессы. В дальнейшем была проведена оценка состояния тканей умерших пациентов, показавшая, что число глиальных клеток в образцах мозга от пациентов, в анамнезе которых была указана тяжелая депрессия, существенно снижено.
В последние два десятилетия представления о мозге сильно изменились. Теперь ясно, что нейрональные и глиальные сети не неизменны, и находятся под контролем множества факторов, таких как факторы внешней среды (например, обучение), и внутренние факторы: нейротрофины, глюкокортикоиды, половые гормоны, и проч. Антидепрессанты стимулируют нейро- и глиогенез, поэтому структурные повреждения, вызванные стрессом и депрессией, не являются необратимыми.
Сегодня считается, что нейрогенез во взрослом мозге ограничен несколькими зонами: гиппокампом и областями, прилегающими к латеральным мозговым желудочкам. Однако появляется все больше данных о том, что образование новых нейронов происходит также в неокортексе. Несмотря на небольшое число этих клеток, они имеют важное значение для функционирования неокортекса. Взаимосвязь психических заболеваний и цитогенеза в дефинитивном неокортексе пока не ясна, но уже ведутся ее доклинические исследования. Возможно, на основе этих работ будут созданы более эффективные подходы к лечению депрессии.
Wittchen HU, Hoefler M, Meister W. Depressionen in der Allgemeinpraxis. Die bundesweite Depressionsstudie. Stuttgart: Schattauer, 2000
Moussavi S, Chatterji S, Verdes E, et al. Depression, chronic diseases, and decrements in health: results from the World Health Surveys. Lancet 2007;370:851-858
World Health Organisation (WHO). The World Health Report 2001. Mental Health: New Understanding, New Hope. Download http://www.who.int/whr/2001/en/whr01_en.pdf
Sahay A, Hen R. Adult hippocampal neurogenesis in depression. Nature Neuroscience 2007;10:1110-1115
Ramon y Cajal, SR. Degeneration and regeneration of the nervous system. London, Oxford University Press, 1928
Czeh B, Mueller-Keuker JIH, Rygula R, et al. Chronic social stress inhibits cell proliferation in the adult medial prefrontal cortex: hemispheric asymmetry and reversal by fluoxetine treatment. Neuropsychopharmacology 2007;32:1490-1503
Источник